
آب پوشی و انرژی شبکه بلور
چکیده:
در درس قبل فرایند انحلال یک ترکیب یونی در آب شرح داده شد و با فرایند آب پوشی و انرژی شبکه بلور آشنا شدید. در این درس به رقابت میان آب پوشی و شبکه بلور در پیشرفت انحلال و هم چنین مقایسه شدت آب پوشی یون ها خواهیم پرداخت.
شرح درس:
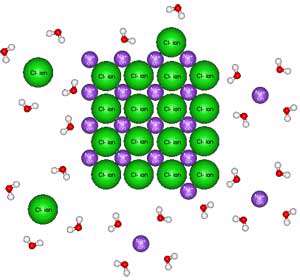
آب پوشی یک فرایند گرماده و موافق پیشرفت انحلال بوده در حالی که انرژی شبکه بلور گرماگیر و مخالف پیشرفت انحلال می باشد. در رقابت بین عامل موافق و مخالف در صورت گرفتن انحلال سه حالت ممکن است پیش بیاید:
1_ ∆Hشبکه< ∆Hآبپوشی:
انحلال صورت می گیرد و دمای محلول بالا می رود زیرا فرایند گرماده خواهد بود.
2-∆Hشبکه>∆H آبپوشی :
اگرچه عامل مخالف بزرگتر است اما خود به خودی بودن انحلال به آنتروپی نیز بستگی دارد. از آنجا که آنتروپی در انحلال یک جامد یونی عامل مساعدی است، میل به افزایش آن سبب صورت گرفتن انحلال می شود. یون ها در شبکه بلوری مقداری از انرژی جنبشی مولکول های پیرامون خود را جذب نموده و آن را صرف سست کردن شبکه بلوری می کنند تا بدین ترتیب فرایند آب پوشی بتواند بتواند بر شبکه بلوری غلبه نموده و یون ها را به داخل آب بکشد. بدیهی است که در این حالت، انرژی جنبشی مولکول های محلول کم شده و دمای محلول پایین می آید.
3- ∆Hشبکه بسیار بزرگتر از ∆Hآبپوشی باشد:
در این حالت انحلال انجام پذیر نیست و حتی افزایش آنتروپی نیز نمی تواند باعث پیشرفت انحلال شود. در این صورت ماده در آب نامحلول است.
شدت آب پوشی در یون های مختلف:
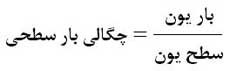
هرچه چگالی بار در سطح یون ها بیشتر باشد مولکول های آب تمایل بیشتری به محاصره یون مورد نظر دارند و انرژی حاصل از آب پوشی بیشتر می شود. آنتالپی آب پوشی یون ها در درجه اول به بار یون ها بستگی دارد زیرا هرچه بار یون بیشتر باشد چگالی بار بیشتر شده و آنتالپی آب پوشی نیز بیشتر می شود. اگر بار یون ها با هم برابر بود، برای مقایسه شدت آب پوشی یون ها به شعاع آن ها توجه می کنیم. هرچه شعاع یون کوچک تر باشد چگالی بار بیشتر شده و انرژی آب پوشی بیشتر می شود.
هرچه بار یون بیشتر و شعاع یون کوچک تر، آنتالپی آب پوشی بیشتر!
مرکز یادگیری سایت تبیان- تهیه و تنظیم: مهسا شاه حسینی


















