
یون کمپلکس / ترکیبات کوئوردیناسیون
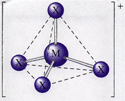
یونهای کمپلکس، یونهای چند اتمی هستند که از یک اتم فلزی واقع در مرکز ترکیب و چند یون کوچکتر متصل در اطراف اتم مرکزیکه لیگاند نامیده می شوند، تشکیل شده اند. نظریهی برونستد- لوری نمیتواند چنین واکنشی را آنطور که نظریهی اسید و باز لوئیس پیشبینی میکند، توضیح دهد. باز لوئیس اغلب لیگاند یک ترکیب کوئوردیناسیون است و در این ترکیب، فلز به صورت اسید لوئیس رفتار میکند، مانند:
Al 3++ 6 H2O <---> [Al(H2O)6]+3

یون آلومینیوم، کاتیون فلزی با ظرفیت پر نشده است و نقش اسید لوئیس را ایفا میکند. آب، جفت الکترون تنها دارد و آنیون است؛ بنابراین نقش باز لوئیس را دارد.
اسید لوئیس، همواره الکترونهای باز لوئیس را که تمایل دارد الکترونهای خود را بدهد، میپذیرد.
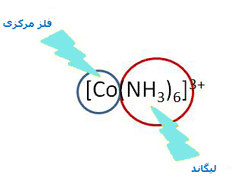
یک مورد جالب و مهم دیگر که نظریهی اسید و باز لوئیس میتواند توضیح دهد، ترکیب حاصل از واکنش آمونیاک با Zn+2 است:
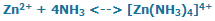
به طور مشابه، یون روی، اسید لوئیس و NH3 باز لوئیس است. حال توجه کنید که این موردی است که نظریهی اسید و باز برونستد - لوری نمیتواند توضیح دهد چگونه این واکنش بدون اینکه شامل یونهای H+ و OH- باشد، اتفاق میافتد. بنابراین، نظریهی اسید و باز لوئیس به ما اجازه میدهد تا تشکیل دیگر گونههای مواد و یونهای کمپلکس را توجیه کنیم که شامل یونهای هیدرونیوم (H+ ) و هیدروکسید (OH- ) نباشند.
نبودH+ و OH- در بسیاری از یونهای کمپلکس میتواند درک این مطلب را که کدام نوع از مواد، اسید و کدام نوع، باز هستند را سخت تر کند.
آمفوتریسم یا دوخصلتی بودن مواد:
اسیدها و بازها دو دستهی متمایز از مواد هستند اما موادی نیز وجود دارند که میتوانند هم اسید و هم باز باشند. آب نیز چنین خصلتی دارد. این خاصیت آب، باعث آمفوتر بودن مولکول آن میشود؛ آب میتواند با دادن پروتون خود به یک مادهی بازی، خاصیت اسیدی داشته باشد و با این از دست دادن H+ ، به اسید مزدوج خود (OH- ) تبدیل شود. از طرفی دیگر، آب میتواند با پذیرفتن یک پروتون از یک اسید، نقش بازی داشته باشد و باز مزدوج خودش (H3O+ ) باشد.
| آب نقش بازی دارد |
 |
| آب نقش اسیدی دارد |

|

باید توجه داشته باشید که درجهی عملکرد یک مولکول به عنوان آمفوتر، بستگی به محیط قرار گرفتن مولکول دارد. یعنی آب در محیط اسیدی، نمیتواند در نقش اسید باشد و در محیط بازی نمیتواند در نقش باز باشد. بنابراین محیطی که مولکول در آن قرار دارد، بر خواص مولکول تأثیر میگذارد. مولکولهای دیگری نیز مانند آب، هم دارای خاصیت اسیدی و هم بازی هستند؛ مانند:
Al(OH)3 + 3H+ --> Al3+ + 3H2O نقش باز دارد:Al(OH)3
Al(OH)3 + OH- --> Al(OH)4- نقش اسید دارد: Al(OH)3
مرکز یادگیری سایت تبیان
تهیه و تنظیم: خدیجه آلچالانلو

















