آشنایی با یون های کمپلکس فلزی (1)
آشنایی با یون های کمپلکس فلزی (1)
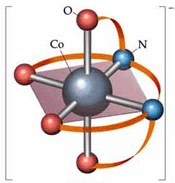
در این مطلب با یون کمپلکس و لیگاند بیش تر آشنا می شویم و پیوند بین لیگاند و یون فلزی مرکزی را بررسی می کنیم.
1. یون های فلزی کمپلکس شامل لیگاندهای ساده:
- یون فلزی کمپلکس چیست؟
در مطلب یون کمپلکس/ ترکیبات کوئوردیناسیون اندکی با تعریف یون کمپلکس فلزی آشنا شدیم.
یون کمپلکس یک یون فلزی در مرکز خود و تعدادی مولکول یا یون دیگر در اطراف خود دارد. این مولکول ها یا یون ها می توانند توسط پیوندهای کوئوردینانسی (کوالانسی داتیو) به یون مرکزی متصل شوند (البته گاهی پیوند واقعا پیچیده تر از حالت یاد شده است).
مولکول ها یا یون های اطراف یون فلزی مرکزی را لیگاند می گوییم.
- خصوصیات لیگاندها
لیگاندهای ساده می توانند آب، آمونیاک و یون های کلرید باشند:
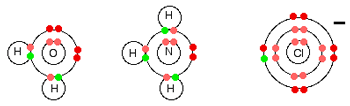
هر سه این ها جفت الکترون فعال تنها در تراز انرژی بیرونی خود دارند و عادت دارند با یون فلزی، پیوندهای کوئوردینانسی تشکیل دهند.
تمام لیگاندها دهنده جفت تنهای خود هستند؛ به بیان دیگر، تمام لیگاندها باز لوئیس هستند.
- پیوند یون های کمپلکس ساده

به یون آلومینیوم قبل از این که مولکول های آب به آن پیوند بخورند، دقت کنید؛ خود آلومینیوم دارای ساختار :
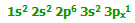
و وقتی سه الکترون خود را از دست می دهد، دارای ساختار:
است. یعنی اکنون اوربیتال های سومین تراز آلومینیوم خالی هستند. پس شش تا از این اوربیتال های خالی را برای پذیرفتن جفت های تنهای شش مولکول آب به کار می برد.
آلومینیوم مجددا اوربیتال 3s، سه اوربیتال 3p و دو تا از اوربیتال های 3d را برای تشکیل شش اوربیتال جدید که همگی انرژی یکسانی دارند، مرتب می کند (پیوند می دهد).
ممکن است سؤال کنید که چرا Al به جای 6 اوربیتال از 4 یا 8 یا هر مقدار اوربیتال دیگری استفاده نمی کند؟
6، تعداد نهایی مولکول های آبی است که ممکن است در اطراف یون آلومینیوم (و بیش تر یون های فلزی دیگر) بگنجند. Al با ساختن تعداد نهایی پیوندها، انرژی بیش تری آزاد می کند و پایدارتر می شود:
فقط یک جفت تنها روی هر مولکول آب نشان داده شده است. جفت تنهای دیگر درگیر پیوند نیست و به سمت دور از آلومینیوم قرار گرفته است:
البته برخی لیگاندها می توانند بیش تر از یک پیوند کوئوردینانسی با یون فلزی تشکیل دهند.
این مورد فقط در فلز واسطه وسطی با مورد دیگر تفاوت دارد.
ساختار الکترونی آهن:
با از دست دادن الکترون های 4s و یک الکترون 3d ،یون Fe3+ دارای ساختار:
است. در تراز پیوندی، به الکترون های داخل اوربیتال ها توجه کنید:
قبل از این که این اوربیتال ها مورد استفاده قرار گیرند، مجددا مرتب (هیبرید) می شوند تا 6 اوربیتال با انرژی یکسان تشکیل دهند.
وقتی پیوندهای کوئوردینانسی تشکیل شدند، یون دقیقا مثل یون آلومینیوم به نظر می رسد:
CuCl4 2-
این مورد، مثالی از تشکیل یون کمپلکس با بار منفی است.
مس ساختار الکترونی زیر را دارد:
وقتی مس، الکترون 4s و یکی از الکترون های 3d خود را از دست می دهد، ساختاری به صورت زیر خواهد داشت:
برای پیوند با چهار یون کلرید به عنوان لیگاند، اوربیتال های 4s و 4p به شکل هیبرید شده برای پذیرفتن جفت تنهای الکترونی از هر یون کلریدی مورد استفاده قرار می گیرند. به دلیل این که یون های کلرید از مولکول های آب بزرگ تر هستند، نمی توانید 6 تا از آن ها را اطراف یون مرکزی بگنجانید، برای همین فقط 4 تا از آن ها را در این شکل می بینید:
تنها 4 جفت تنها روی هر یون کلرید نشان داده شده است. سه تای دیگر شامل پیوند نیستند و به دور از یون مس قرار دارند.
مرکز یادگیری سایت تبیان
نهیه و تنظیم: خدیجه آلچالانلو
