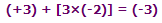آشنایی با یون های کمپلکس فلزی (2)
بحث قبلی راجع به یون های فلزی کمپلکس ، شامل لیگاندهای ساده بود، مطالعه این بحث قبل از شروع مطلب زیر الزامی است.
در بحث قبل با لیگاندهایی روبه رو شدیم که تک دندانه ای بودند؛ یعنی هر لیگاند، یک پیوند با یون فلزی مرکزی تشکیل می دهد. برخی از لیگاندها بیش از یک دندانه دارند! این لیگاندها را چند دندانه ای می نامند که می توانند به انواع مختلفی تجزیه شوند.
2. یون های فلزی کمپلکس شامل لیگاندهای پیچیده:
لیگاندهای تک دندانه ای
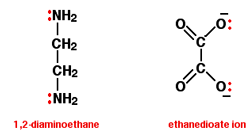
این لیگاندها دو جفت تنها دارند، هر کدام از آن ها می توانند به یون فلزی مرکزی پیوند بخورند.
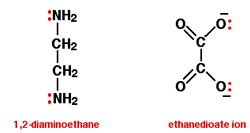
دو مدل از این لیگاندها 1,2- دی آمینو اتان (نام قدیمی : اتیلن دی آمین که اغلب به اختصار آن را " اِن " (en) می نامند) و یون اتان دیونات (نام قدیمی : اُکسالات).
در یون اتان دیونات، جفت های تنهای بیش تر از دو جفت تنهای نشان داده شده، وجود دارند؛ اما ما به این دو جفت تنها علاقه داریم.
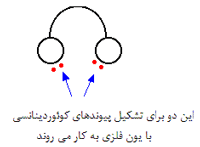
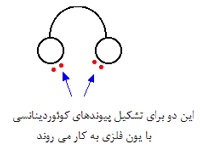
می توانید این گونه تصور کنید که اگر لیگاندهای دو دندانه ای مثل یک هدفون در نظر گرفته شوند، جفت های تنها روی هر گوشی هدفون حمل می شوند. با این توصیف، این لیگاندها جای دنجی اطراف یون فلزی برای خود خواهند یافت.
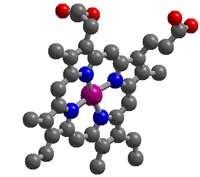
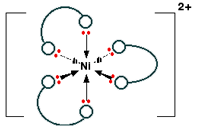
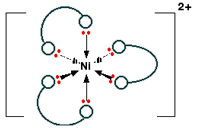
این ترکیب را به فرم اختصاری Ni(en)3] 2+ ] نیز می نویسند.
ساختار این یون به صورت زیر است:
در این مورد، گوشی ها اتم های نیتروژن از گروه NH2 و تکه ای از هدفون که روی سر شما قرار می گیرد، گروه CH2CH2- - است.
توجه داشته باشید که آرایش پیوندها در اطراف یون فلزی مرکزی دقیقا مثل وقتی است که یون ها به 6 مولکول آب متصل بودند. تنها تفاوت آن است که این بار، هر لیگاندی در دو وضعیت مورد استفاده قرار می گیرد؛ در زوایای قائمه نسبت به یکدیگر.
به دلیل این که نیکل 6 پیوند کوئوردیناسیون تشکیل می دهد، عدد کوئوردیناسیون این یون، 6 است. با وجود این واقعیت که تنها به 3 لیگاند چسبیده است.
عدد کوئوردیناسیون تعداد پیوندها را می شمارد؛ نه تعداد لیگاندها را.
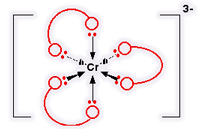
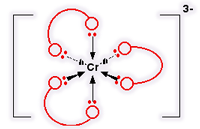
Cr (C2O4)3 3-
این یون کمپلکس با متصل شدن 3 یون اتان دیونات (اُکسالات) به یک یون کروم (III) تشکیل می شود. این یون هم شبیه مورد نیکل قبلی است. تنها تفاوت واقعی، تعداد بارهاست. یون کروم بار +3 حمل می کند و هر یون اتان دیونات، بار -2 دارد؛ یعنی:
ساختار این یون:
لیگاند 4 دندانه ای
لیگاند 4 دندانه ای، 4 جفت تنها دارد که تمام آن ها می توانند با یون فلزی مرکزی پیوند داشته باشند.
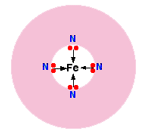
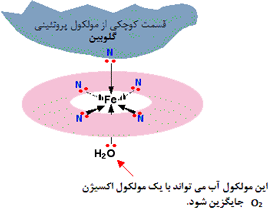
مثالی از این لیگاند در مورد هموگلوبین اتفاق می افتد:
قسمت اصلی هموگلوبین، یون آهن (II) است که با مولکول پیچیده ای به نام "همو" احاطه شده است. این مولکول، نوعی حلقه توخالی از اتم های کربن و هیدروژن است که در مرکز آن، 4 اتم نیتروژن با جفت های تنهای خود قرار دارند.
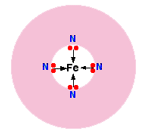
شکل ساده شده این یون را در زیر می بینید:
هر کدام از جفت های تنها روی نیتروژن می توانند پیوند کوئوردیناسیون با یون آهن (II) که در مرکز حلقه پیچیده اتم ها قرار می گیرد، تشکیل دهند.
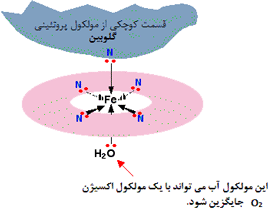
آهن، 4 پیوند کوئوردینانسی با "همو" تشکیل می دهد؛ اما برای تشکیل دو پیوند بیش تر هم جا دارد؛ یکی بالا و دیگری پایین صفحه حلقه.
پروتئین گلوبین با استفاده از یک جفت تنها روی اتم نیتروژن در یکی از اسیدهای آمینه اش، به یکی از این مکان های بالا یا پایین صفحه می چسبد.
مولکول آبی که به انتهای یون پیوند خورده است، به راحتی با مولکول اکسیژن جایگزین می شود (از طریق جفت تنها که روی یکی از اکسیژن های O2 است) و این وضعیت، نشان دهنده نحوه انتقال اکسیژن در اطراف خون توسط هموگلوبین است.
لیگاند 8 دندانه ای
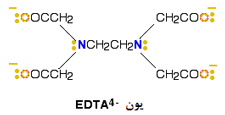
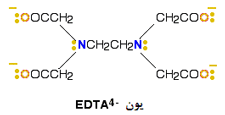
این لیگاند، 8 جفت الکترون تنها دارد که همگی آن ها می توانند با یون فلزی پیوندهای کوئوردیناسیون تشکیل دهند. بهترین مثال از این مورد، EDTA است.
شکل زیر یون - EDTA4 را نشان می دهد.
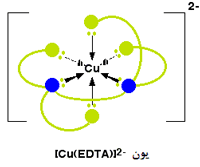
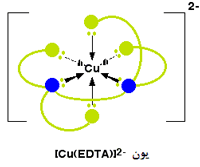
عدد کوئوردیناسیون دوباره در این مورد، 6 است زیرا 6 پیوند کوئوردینانسی توسط یون فلزی مرکزی تشکیل می شود. شکل زیر یون مس (II) را متصل به این یون نشان می دهد:
بار کل این یون، مجموع بار +2 یون اصلی مس (II) و بار 4- یون EDTA4- است که 2- خواهد شد.
مرکز یادگیری سایت تبیان
تهیه و تنظیم: خدیجه آلچالانلو