
ساخت غشاء دیالیز با آنزیم اوره آز، دستاورد برتر دوره اول علامه حلی 9 در بخش سمینار
دوازدهمین دوره از پروژه های دانش آموزی تبیان نیز با یاری خداوند و حضور پر شور شما دوستان و علاقمندان به پایان رسید.
در این دوره از جشنواره تعداد 126 گروه در بخش های سمینار های علمی، غرفه های نمایشگاهی و مسابقات به عنوان گروه های برتر، برگزیده و معرفی شدند.
بر آن شدیم تا با معرفی پروژه های گروه های برتر علاوه بر قدردانی از این دوستان نوآور، زمینه ای را برای ایده پروری سایر پژوهشگران علاقمند فراهم آوریم.
مقطع: دوره اول متوسطه
موضوع: ساخت غشاء دیالیز با استفاده از تثبیت آنزیم اوره آز توسط نانو ذرات طلا بر سطح غشاء نیتروسلولزی
نام مدرسه: دبیرستان علامه حلی 9
نام استاد: آقای علیرضا منتظری
دانش آموزان: محمد مهدی قاسمی، عرفان بدری
چکیده:
آنزیم اوره آز )اوره آمیدو هیدرولاز EC 3.5.1.5 ( یکی از آنزیم های کارآمد سیتوزولی، هیدرولیز اوره به آمونیاک و دی اکسید کربن را کاتالیز می کند. یکی از موارد کاربرد اوره آز، تثبیت این آنزیم ها بر روی بستری ویژه به منظور نیل به اهداف گوناگون می باشد. امروزه استفاده از نانو ذرات، و به طور ویژه نانو ذره طلا در حوزه های گوناگون به دلیل ویژگی های خاصشان، توجه زیادی را به خود معطوف داشته اند.
اوره آز تثبیت شده به طور گسترده در صنایع غذایی، صنعت کشاورزی، فاضلاب و به طور ویژه در حوزه پزشکی استفاده می شود.
در این پژوهش آنزیم اوره آز، تحت شرایط دمای 25 درجه سانتیگراد و pHبرابر 7.4 از جوانه دانه های لوبیا قرمز در روزهای اول، دوم و سوم استخراج و جهت تثبیت، مورد سنجش آنزیمی قرارگرفت. شناسایی آنزیم و همچنین بررسی های کاتالیتیکی آنزیم به منظور انتخاب آنزیمی که بیش ترین فعالیت در بین سه آنزیم استخراجی را داراست توسط معرف نسلر بر اساس تولید آمونیاک در طول موج 405 nm با استفاده از روش اسپکتروفوتومتری ماوراء بنفش(UV-VISIBLE Spectrophotometer) صورت پذیرفت. نهایتا پس از انجام آزمایشات کاتالیتیکی و سنجش فعالیت آنزیمی، آنزیم اوره آز با استفاده از نانو ذرات طلا و به طریق کووالان توسط عامل شیمیایی گلوتار آلدیید بر روی غشاء نیتروسلولوزی تثبیت شد. نتایج به دست آمده از سنجش آنزیم تثبیتی اوره آز، حاکی است که آنزیم اوره آز استخراجی از جوانه یک روزه گیاه لوبیا قرمز در pH بافری برابر 7.4، بیشترین فعالیت را نسبت به سایر آنزیم های استخراجی نشان داد. اتصال صحیح و مناسب آنزیم اوره آز بر سطح غشاء نیتروسلولزی توسط عکس برداری میکروسکوپ نیروی اتمی(AFM)و طیف سنجی تبدیل فوریه(FTIR) به نمایش گذاشته شد.
بیان مسئله:
آنزیم ها بیو مولکول هایی هستند که به وسیله سلول ها سنتز می شوند و واکنش های خاصی را تحت شرایط ملایم عملی می سازند. آنزیم ها روی سوبسترا عمل می کنند و سرانجام باعث تبدیل سوبسترا به محصول می شوند. از آنزیم ها استفاده های درمانی و صنعتی فروانی می شود. آنزیم ها غالبا محلول در آب هستند، زیست تخریب پذیر هستند و در شرایط نرمال دما، فشار و pH عمل می کنند. از مزایای بی تحرک کردن و تثبیت آنزیم آن است که جدا سازی از محیط واکنش آسان می شود و بهای تولید کاهش می یابد.
تثبیت با روش هایی از قبیل: جذب سطحی، پیوند یونی، به تله انداختن، اتصال عرضی 1 و پیوند کووالان صورت می پذیرد. سطحی که آنزیم روی آن تثبیت می شود وظایفی حیاتی از قبیل نگهداری ساختار سوم آنزیم دارد که فاکتور مهمی است در حداکثر کردن پایداری حرارتی آنزیم در سطحی که تثبیت روی آن صورت می پذیرد. روش بی تحرک سازی آنزیم باید طوری طراحی شود که تغییرات در مختصات آنزیمی به حداقل برسد.
تثبیت نتیجه تشکیل تعدادی پیوند بین آنزیم و سطح ساپورت (ماتریکس) است.
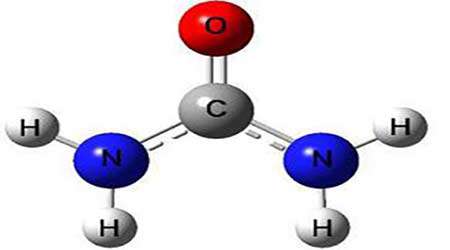
آوره آز یک آنزیم حاوی نیکل است. اوره آز در گیاهان و میکروب ها (باکتری ها و قارچ ها) نیز یافت می شود، در حالی که همه آنها ساختار مشابهی دارند و مکانیسم کاتالیز آنها نیز مشابه است.
اوره آز، اوره را به آمونیاک و دی اکسید کربن کاتالیز می کند. بهترین اوره آز از Jack beanاستخراج می شود. اوره آز باکتریایی یک آنزیم کلیدی است که به وسیله باکتری های پاتوژن استفاده می شود که سبب زخم معده، ایجاد سنگ های اوره ای و بیو فیلم دهانی می کند.
یک منبع نسبتا ارزان برای اوره آز، استخراج عصاره خام پودر نخود است. مصارف اوره آز زیاد است به طور مثال در کیت های تشخیص اوره خون، در صنعت نوشابه سازی برای کاهش میزان الکل و در بیوسنسورهای سیستم همودیالیز نیز به کار می رود.
درSoybean ، آنزیم اوره آز نقش مهمی در طول پروسه تکثیر ایفا می کند و پروتئین های ذخیره شده در دانه را به منظور تغذیه نهال به مصرف می رساند.
تثبیت آنزیم روی ساپورت جامد به وسیله جفت شدن کووالان، معمولا به ویژگی های خیلی پایداری می انجامد. مزیت تثبیت آنزیم به وسیله پیوند کووالان آن است که سبب می شود پروتئین ها در حضور محلول یونی قوی در محلول گم نشوند.
در سال Braconnot Franch 1833 اولین فردی بود که نیتروسلولز را تدارک دید. نیتروسلولز، نیترات پلیمرهای سلوبیوزاست که شامل دو بخش متوالی از گلوکز است که به وسیله یک پیوند بتا گلی کوزیدی به هم اتصال می یابند.
منظور ما از تحقیق پیش رو آن است که اوره آز استخراجی از جوانه لوبیا قرمز را با استفاده از نانو ذرات طلا روی غشای نیتروسلولزی به شیوه کووالان تثبیت نماییم.
فرضیه:
1. نانو ذرات طلا در فرایند تثبیت آنزیم اوره آز نقش مکملی در نحوه اتصال پیوند کووالان آنزیم بر ماتریکس ایفا می کنند.
2. آنزیم اوره آز توانایی در شکستن مولکول های اوره بعد از اتصال بر ماتریکس از خود به نمایش می گذارد.
اهمیت و ضرورت انجام تحقیق:
به دلیل اهمیت گسترده و استفاده روز افزون آنزیم ها در صنایع پزشكی و تولید مواد غذایی مطلوب، استفاده چند باره از آنزیم ها و پایین آوردن هزینه از مطالبات شكل گرفته و گسترش یافته در زمان حاضر است. اوره آز، بدلیل فراوانی در اقسام گوناگونی از دنیای زنده می تواند راهگشای بسیاری از بیماری ها و مشكلات پیش روی انسان شود. چرا که طیف وسیعی از قبیل گیاهان، برخی باکتری ها، مهره داران و بی مهرگان یافت می شود.
به خاطر ناپایداری آنزیم ها، استفاده از آن ها با محدودیت مواجه است و تثبیت اوره آز درNylon tube ، کربوکسی میتل سلولز، پلی آکریل آمید و ژلاتین صورت گرفته است .اوره آز اثرات قابل توجهی در نارسایی ها و بیماری های کلیوی دارد و همین طور در کشاورزی برای تخمین اوره در محصولات حائز اهمیت است. به طور کلی در راستای بهره برداری از آنزیم های تثبیت شده، تثبیت آنزیم در پزشكی به دو طبقه بزرگ بخش می شود Bioreactors, Biosensors .
همین طور استفاده از آنزیم های تثبیت شده در تشخیص و درمان بیماری های متعدد با استفاده از سنسورهای بیواکتیو در تشخیص سطوح بیماری را می توان از مزایای تثبیت آنزیم بر شمرد.
جنبه جدید بودن تحقیق:
بهره گیری از آنزیم اوره آز که استفاده های فراوانی در پزشكی، صنایع غذایی و کشاورزی دارد و تثبیت آن روی غشای نیتروسلولزی به پایداری طولانی آنزیم کمك می کند، به این موارد اگر استفاده از پیوند کووالان در تثبیت آنزیم و افزودن پایداری را بیفزایید، می توان شیوه نوینی را پیش رو دید.
اهداف تحقیق:
هدف عمده و مهم ترین آرمان تحقیق آن است که آنزیم اوره آز با حداقل تغییر نسبت به زمانی که تثبیت نشده، بی تحرک شود به نحوی که ویژگی های سینیتیكی و کاربردی آن تغییر نكند.
منابع:
1. Agnieszka Sirko and Robert Brodzik,(2000),Plant Urease : Roles and Regulations,Institute of Biochemistry and Biophysics, Polish Academy of Science, Poland, Vol 47,1189-1195
2. Ahmad Abolpouret al,(2013),Enzyme immobilization: an update,Springer, 6:185-205
3. B Carpentier and O. Cerf,(1993), Biofilms and Their Consequence, with Particular Refrence to Hygiene in the Food Industry, Journal of Applied Bacteriology, Vol 75, 499-511
4. B.Menna,C.Torres,M.Herro,V.Rives,(2008),Protein Adsorption to Organically –Modified Silica Glass Leads to a Different Structure Than Sol-Gel Encapsulation,Biophysical Journal ,Vol 95,51-53
5. BanKpaliil Leela Krishna,Abhay Narayan Singh,Sanjukta Patra,Vikash Kumar Dubey ,(2011),Purification, Characterization and Immobilization of Urease from Momordica Charantia Seeds,Indian Journal of Biotechnology , Vol 46, 1486-1491
6. Barnet LB, Bull HB,(1959), The Optimum PH of Adsorbed Ribonuclease. Biochim J, Vol 36, 244-246
7. Beatriz Brena,Francisco Batista, (2013),Immobilization of Enzymes:A Literature Review,Methods in Molecular Biology, Vol 1051
برای مشاهده مجموعه فایل های ضمیمه اینجا کلیک کنید.
بخش پژوهش های دانش آموزی تبیان
تهیه: نگار تجملیان- تنظیم: نسرین صادقی

















