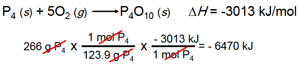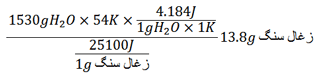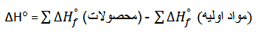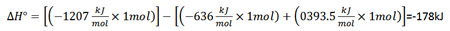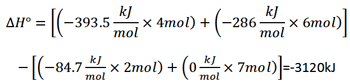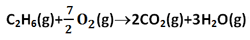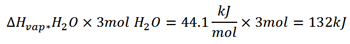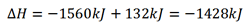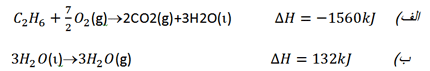گرما شیمی – بخش سوم
مطالعه و بررسی تغییرات گرما در واکنش های شیمی را گرما شیمی می نامند.
در مطلب قبل دانستید که گنجایش گرمایی یک گرماسنج را می توان با اندازه گیری تغییر دمای حاصل از مقدار ثابتی انرژی الکتریکی اندازه گرفت. حال مسائل مربوطه را بررسی می کنیم.
حالت فیزیکی همه واکنش گرها و محصولات، همواره باید در معادلات گرما شیمی مشخص شوند.
گرمای آزاد شده در هنگام سوختن 266 گرم فسفر سفید (P4) در هوا را طبق معادله زیر محاسبه می کنیم.
حال برای درک بهتر به حل مسائل مربوط به گرما شیمی می پردازیم.
گرمای احتراق یک نمونه زغال سنگ 25/1kJ می باشد، حال چند گرم از این زغال سنگ را باید بسوزانیم تا گرمای کافی برای بالا بردن دمای 1530 گرم آب از 283K به 337K را فراهم سازد؟
ابتدا باید فرمولی برای به دست آوردن جرم زغال سنگ سوخته شده بنویسید و سپس اعداد را با توجه به داده های مسئله در جای خود قرار دهید.
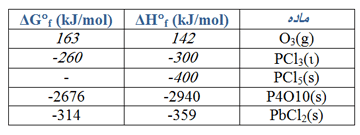
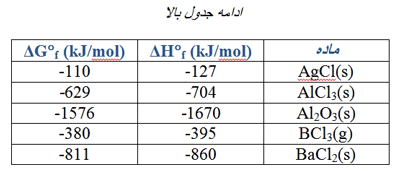
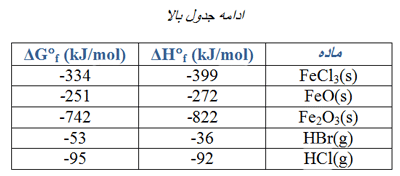
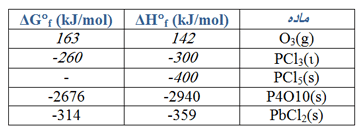
گرمای استاندارد واکنش زیر، ∆H° را حساب کنید.
CaO(s) + CO2(g) → CaCO3(s)
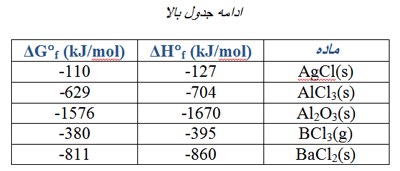
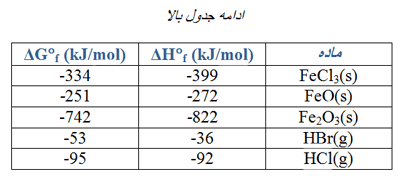
از مقادیر ∆H°f در جدول های زیر می توانید استفاده کنید. (روی عکس ها کلیک کنید.)
ابتدا معادله زیر را می نویسیم و سپس اعداد را در فرمول قرار می دهیم.
∆H° واکنش زیر را در 25 درجه سانتی گراد محاسبه کنید.
2C2H6(g)+7O2(g)→4CO2(g)+6H2O(ι)
با استفاده از فرمول مسئله بالا می توان این چنین اعداد را جایگزاری نمود.
در این جا باید توجه داشته باشد که ∆H°fO2(g)=0 می باشد. بنابر تعریف گرمای تشکیل هر عنصر در حالت استاندارد برابر صفر است، بنابراین ∆H°f برم مایع در دمای 25 درجه سانتی گراد و 1atm برابر صفر است اما ∆H°f برم گازی شکل صفر نمی باشد. عنصر باید در پایدارترین حالت باشد تا ∆H°f آن برابر با صفر بشود.
گرمای تبخیر H2O(ι) در دمای 298K برابر با 44.1kJ/mol است. با استفاده از نتایج مسئله بالا، ∆H واکنش را محاسبه کنید.
این معادله از دو نظر با معادله مسئله بالا تفاوت دارد. همه کمیت های مولی نصف شده اند، بنابراین می توانیم مقادیر محاسبه شده ∆H° را بر 2 تقسیم کنیم. بدین ترتیب، 3120/2=1560kJ/mol به دست می آید. همچنین یکی از محصولات به جای 3H2O(ι) , 3H2O(g) است. از این رو گرمای واکنش متفاوت خواهد بود.
* v مخفف کلمه vaporization به معنی تبخیر است.
برای حل این مسائل چند روش وجود دارد. می توان استدلال کرد که چون برای تبخیر آب گرما لازم است، پس واکنشی که منجر به تشکیل H2O(g) می شود نسبت به واکنشی که H2O(ι) تشکیل می دهد، گرمای کمتری آزاد می کند (کمتر منفی است). مقداری از گرمای ایجاد شده صرف تبخیر آب می شود.
از سوی دیگر می توان از قانون ثابت بودن جمع گرماها (قانون هس) استفاده کرد. بنابراین قانون، انرژی آزاد شده در یک واکنش مستقل از مسر واکنش بوده، با جمع جبری تغییرات گرما در مراحل واکنش برابر است. معادله واکنش این مسئله را می توان به دو واکنش که ∆H آنها معلوم است، تبدیل کرد.
از جمع جبری دو معاله (الف) و (ب) داریم:
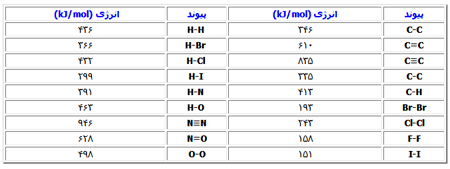
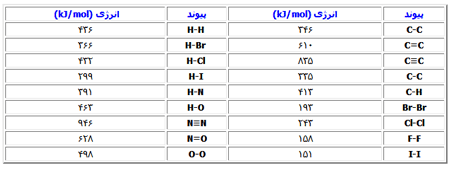
با استفاده از جدول انرژی های پیوند، جدول شماره 2 می توانید ∆H° واکنش زیر را محاسبه کنید.
H2(g)+I2(g)→2HI(g)
در اینجا چون انرژی پیوند مقدار گرمایی است که برای شکستن پیوند باید جذب شود، همیشه مقدار آن مثبت می باشد و معمولا برحسب kJ/mol بیان می شود. وقتی همه گونه ها در فاز گازی باشند، این امر صدق می کند. گرمای واکنش را می توان با استفاده از معادله زیر محاسبه کرد.
بنابراین، واکنش مورد نظر باید تجزیه و تحلیل شود تا پیوندهایی که شکسته می شود و پیوندهایی که تشکیل می شود، تعیین گردد. در واکنش بالا پیوند H-H در ماده اولیه H2(g) و پیوند I-I در ماده اولیه I2(g) شکسته می شود و دو پیوند H-I تشکیل می شود HI(g) . با جایگزین کردن مقادیر، خواهیم داشت:
∆H=[436kJ+151kJ]-[2(299kJ)]=-11kJ
گرما شیمی (1)
گرما شیمی (2)
منبع:
http://kashanu.ac.ir
مرکز یادگیری سایت تبیان - مرجان سلیمانیان