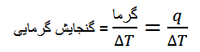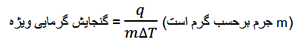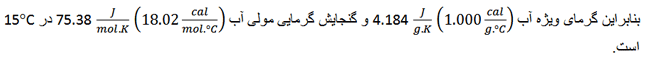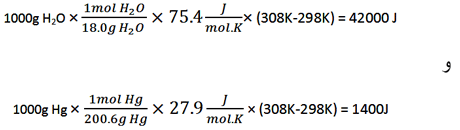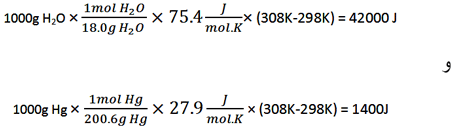گرما شیمی (2)
گرمای آزاد شده را به صورت کمیتی منفی و گرمای جذب شده را به صورت کمیتی مثبت نشان می دهند.
در مطلب قبل آموختید که با استفاده از ΔH می توانیم اطلاعات شیمیایی زیادی را نظم بدهیم و به یکدیگر مربوط سازیم. حال به ادامه این مبحث می پردازیم.
گرماسنجی شاخه ای از علوم است درباره اندازه گیری گرما. دستگاهی که برای اندازه گیری گرما به کار می رود کالری سنج می نامند. در کالری سنج تغییر دما و رابطه میان گرما و دما را اندازه می گیریم تا میزان گرما را پیدا کنیم.
گنجایش گرمایی یک سیستم یا یک ماده به صورت زیر تعریف می شود:
گنجایش گرمایی یک گرماسنج را می توان با اندازه گیری تغییر دمای حاصل از مقدار ثابتی انرژی الکتریکی اندازه گرفت. دما معمولا برحسب کلوین یا سلسیوس اندازه گرفته می شود.
زمانی که گنجایش گرمایی گرماسنج را بدانیم و تغییر دما را اندازه بگیریم، محاسبه q ساده خواهد بود. اگر فشار داخل گرماسنج ثابت باشد پس q=ΔH خواهد بود.
گنجایش گرمایی، گرمای q لازم برای به وجود آمدن تغییر دما ΔT در یک ماده است. این مقدار نه تنها به ماهیت ماده بستگی دارد بلکه به مقدار ماده نیز وابسته است. بنابراین می توانیم گنجایش گرمایی مولی را به عنوان مقدار گرمای لازم برای تغییر دمای یک مول ماده به اندازه یک درجه کلوین در نظر بگیریم.
مقدار گرمای لازم برای تغییر دمای یک گرم ماده به اندازه یک درجه کلوین گرمای ویژه آن ماده نام دارد.
به رابطه میان گنجایش گرمایی مولی و گنجایش گرمایی ویژه توجه کنید:
گنجایش گرمایی مولی = جرم مولی × گنجایش گرمایی ویژه
محاسبه شامل این کمیت ها به رابطه میان چهار پارامتر بستگی دارد. با داشتن سه تا از این پارامترها، پارامتر چهارم را می توان به آسانی محاسبه کرد. معمولا مقدار q پارامتری است که باید محاسبه شود.
در فشار ثابت رابطه میان گنجایش گرمایی، آنتالپی و تغییر دما محاسبه می شود:
مسئله:
حساب کنید چه مقدار گرما برای H2O در مقایسه با Hg لازم است. این اختلاف، گنجایش گرمایی زیاد و غیر معمول آب را منعکس می کند.
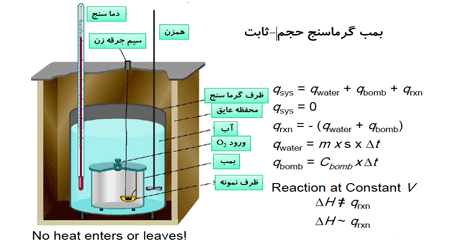
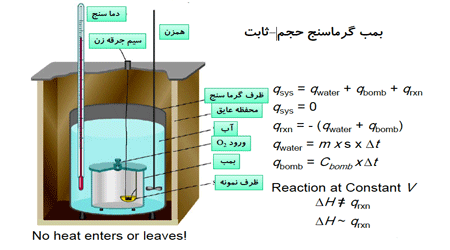
نکته: گرما سنجی را در حجم ثابت و فشار ثابت بررسی می کنند.
گرما سنجی در حجم ثابت
ادامه دارد...
گرما شیمی (1)
گرما شیمی (3)
منبع:
http://kashanu.ac.ir
مرکز یادگیری سایت تبیان - مرجان سلیمانیان