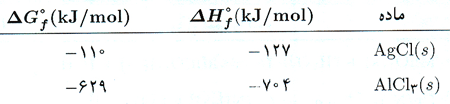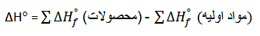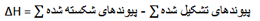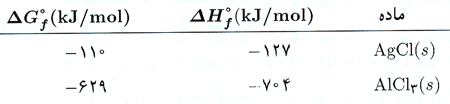گرما شیمی (1)
فرایندهایی که گرما آزاد می کنند، گرمازا و آنهایی که گرما جذب می کنند، گرماگیر نامیده می شوند.
می دانید که تقریبا هر تغییر فیزیکی یا شیمیایی با آزاد شدن یا جذب گرما همراه می باشد.
گرمای آزاد شده به صورت کمیتی منفی و گرمای جذب شده به صورت کمیتی مثبت نشان داده می شود. مقدار گرمای جذب شده با آزاد شده به عوامل بسیاری از جمله شرایطی که فرایند در آن شرایط انجام می شود، بستگی دارد.
تغییرات فیزیکی و شیمیایی معمولا در ظرف هایی انجام می شود که در معرض جو باشند، در نتیجه فشار ثابت می باشد.گرمای جذب شده یا آزاد شده در واکنش هایی که در فشار ثابت انجام می شوند، مربوط به تغییر خاصیتی است که آن را آنتالپی یا محتوای گرمایی می نامند. آنتالپی را با نماد H و تغییر آنتالپی را که در نتیجه تغییر فیزیکی یا شیمیایی است با HΔ نمایش می دهند. (HΔ برابر با آنتالپی محصولات واکنش منهای آنتالپی مواد اولیه می باشد.)
گرماشیمی قسمتی از حوضه وسیع ترمودینامیک می باشد. ترمودینامیک، مطالعه علمی تبادل گرمایی و انواع دیگر انرژی می باشد.
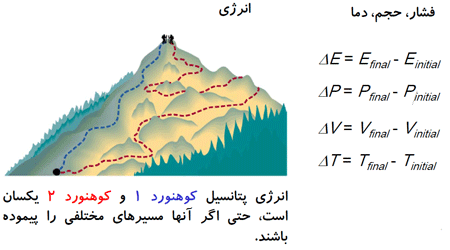
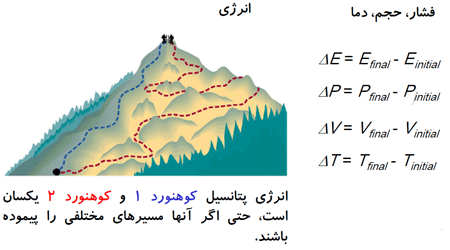
توابع حالت، خواصی هستند که به وسیله حالت سیستم، صرف نظر از اینکه چگونه آن حالت بدست آمده است، تعیین می شوند.
با استفاده از ΔH می توانیم اطلاعات شیمیایی زیادی را نظم بدهیم و به یکدیگر مربوط سازیم. برای سهولت، به انوع تغییرات آنتالپی نام های متفاوتی می دهیم. ΔH هر واکنش شیمیایی را گرمای واکنش می نامند. ΔH واکنش سریع یک ماده با O2 گرمای احتراق ماده نام دارد.
ΔH واکنش تشکیل یک ماده از عناصر سازنده اش، گرمای تشکیل ماده نام دارد. مقادیر ΔH تغییر فازهای مختلف نیز نام های مخصوص به خود دارند. ΔH تبدیل مایع به گاز گرمای تبخیر، ΔH تبدیل جامد به مایع گرمای ذوب و ΔH تبدیل جامد به گاز گرمای تصعید نام دارد.
مقدار ΔH به شرایطی که فرایند انجام می شود نیز بستگی دارد. بنابراین باید به شرایط تغییر ΔH بسیار دقت کنیم. از این رو، می توانیم میان فرایندهای مختلف، مقایسه ای مفهومی انجام دهیم.برای سهولت، حالت استاندارد را تعریف کردیم.  در حالت استاندارد فشار هر جز در سیستم دقیقا 1atm است. تغییر آنتالپی را معمولا در این شرایط به صورت نشان می دهیم.
در حالت استاندارد فشار هر جز در سیستم دقیقا 1atm است. تغییر آنتالپی را معمولا در این شرایط به صورت نشان می دهیم.
فرایندها را معمولا در 298K (بیست و پنج درجه سانتی گراد) در نظر می گیریم، مگر این که شرایط دیگری بیان شود. همچنین فرض می کنیم که همه مواد در فشار 1atm و دمای 298K پایدارترین حالت خود را دارند.
گرمای استاندارد تشکیل یک ماده، ∆H°f کمیتی مهم است. گرمای تشکیل یک ماده مقدار گرمایی است که به هنگام تشکیل یک مول ماده از عناصر سازنده اش، آزاد یا جذب می شود. هر یک از این اجزا در فشار 1atm و دمای 298K پایدارترین حالت را دارند. بنابراین ∆H°f آب مربوط به تشکیل آب مایع از H2 (g) و O2 (g) است. جدول مقادیر ∆H°f در جدول 1 زیر آورده شده است. (ادامه جدول را از اینجا می توانید مرور کنید.)
میان مقادیر ∆H°f اجزای واکنش و ∆H° واکنش رابطه ساده ای وجود دارد: گرمای واکنش مساوی است با مجموع گرما های تشکیل محصولات منهای مجموع گرماهای تشکیل مواد اولیه.
کمیت دیگری که به گرمای واکنش مربوط است، انرزی پیوند نام دارد. از تشکیل پیوند شیمیایی گرما آزاد می شود، بنابراین برای شکستن یک پیوند گرما لازم است. انرژی پیوند میانگین گرمای لازم برای شکستن نوع خاصی از پیوند شیمیایی در یک ماده مرکب در فاز گازی به اتم های تشکیل دهنده اش در فاز گازی است.
انرژی پیوند معمولا برحسب kJ/mol یا kcal/mol بیان می شود و همیشه مقدارش مثبت می باشد. انرژی های پیوند در جدول 2 در زیر آورده شده است.
|
پیوند |
انرژی (kJ/mol) |
پیوند |
انرژی (kJ/mol) |
|
C-C |
346 |
H-H |
436 |
|
C=C |
610 |
H-Br |
366 |
|
C≡C |
835 |
H-Cl |
432 |
|
C-C |
335 |
H-I |
299 |
|
C-H |
413 |
H-N |
391 |
|
Br-Br |
193 |
H-O |
463 |
|
Cl-Cl |
243 |
N≡N |
946 |
|
F-F |
158 |
N=O |
628 |
|
I-I |
151 |
O-O |
498 |
مقادیر میانگین انرژی پیوند را می توان برای ارزیابی بسیاری از گرماهای واکنش به کار برد. رابطه بیگ گرمای واکنش و انرژی پیوند به صورت زیر می باشد:
 این نکته را به خاطر داشته باشد که انرژی های پیوند برای مواد در فاز گاز تعریف شده اند. بنابراین از این روش فقط وقتی می توان استفاده کرد که همه اجزای واکنش گاز باشند.
این نکته را به خاطر داشته باشد که انرژی های پیوند برای مواد در فاز گاز تعریف شده اند. بنابراین از این روش فقط وقتی می توان استفاده کرد که همه اجزای واکنش گاز باشند.
کمیت گرما را با واحدهای مختلف می توان بیان کرد. واحد SI این کمیت ژول (J) است. واحد متداول دیگر کالری (cal) می باشد. 1cal=4/184J
کالری مقدار گرمای لازم برای افزایش دمای 1 گرم آب به اندازه 1 درجه سانتی گراد (از 5/14 درجه سانتی گراد به 5/15 درجه سانتی گراد) است. برای مقادیر بزرگ از کیلو ژول (kJ) یا کیلوکالری (kcal) استفاده می کنیم.
ادامه دارد ...
گرما شیمی (2)
گرما شیمی (3)
مرکز یادگیری سایت تبیان - مرجان سلیمانیان
منبع:
http://kashanu.ac.ir