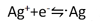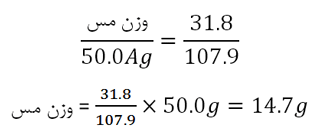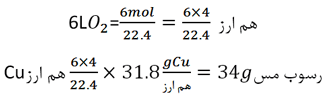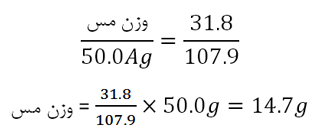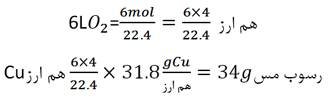حل مسائل (قانون فارادی )
یکی از نمونههای سنجش حجمی که برای بسیاری آشناست سنجشهای حجمی اسید-باز میباشد که در آن نقطه هم ارزی با تغییر رنگ یک شناساگر شناسایی میشود.
مایکل فارادی (Michael Faraday)، فیزیکدان و شیمیدان انگلیسی بود که بیش تر به سبب نوآوریهایش در الکترومغناطیس و الکتروشیمی مشهور است. کشف بنزن و قوانین مربوط به القای الکترومغناطیسی و تهیه کلر مایع از مهمترین دستاوردهای او برشمرده میشوند.
فارادی دربارهٔ میدان مغناطیسی موجود در دور یک رسانا که جریان DC حمل میکند مطالعاتی داشت و مفاهیم اولیه میدان الکترومغناطیس را در فیزیک بنیان نهاد. وی القای الکترومغناطیسی و قانونهای برقکافت را کشف کرد. او اثبات کرد که خاصیت مغناطیسی میتواند بر روی شعاعهای نور اثر میگذارد و رابطهای اساسی بین این دو برقرار است. اختراعات او در زمینه دستگاههای چرخنده الکترومغناطیس اساس فناوری موتور الکتریکی را پی ریزی کرد و این وضع ناشی از تلاشهای او در زمینه کاربرد الکتریسیته در فناوری بود.
پدیدهٔ القای الکترومغناطیسی ( Electromagnetic induction) هنگامی رخ میدهد که حول یک سیم پیچ، میدان مغناطیسی را کم یا زیاد کنیم. القای مغناطیسی که با نام القای الکترو مغناطیسی نیز شناخته میشود پدیدهای فیزیکی است که با تولید پتانسیل الکتریکی در پهنای یک رسانای برقی نمایان میشود.
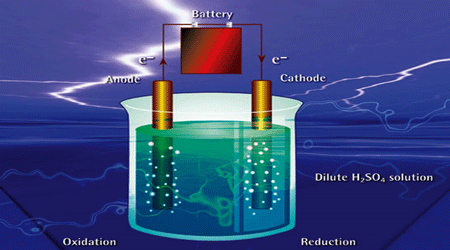
هنگامی که یک فاراده الکتریسیته از یک محلول الکترولیت عبور می کند، یک وزن هم ارز از ماده (برحسب گرم) بر سطح هر الکترود واکنش می دهد یعنی تجزیه یا آزاد می شود. این تعمیم مهم بخشی از یک تعمیم وسیع تر به نام قانون فاراده است.
توجه کنید که چون یک وزن هم ارز از ماده ای مانند Ag+ حاوی 1023 × 6/002 یون است، بر اساس واکنش زیر 1023 × 6/002 الکترون برای تشکیل یک وزن هم ارز از رسوب الکتروشیمیایی نقره لازم است. چون یک فاراده الکتریسیته یک وزن هم ارز از نقره را رسوب می دهد، یک فاراده باید معادل 1023 × 6/002 الکترون باشد. بر این اساس می توان گفت که یک فاراده یک مول الکترون می باشد.
مثال:
مقدار معینی جریان الکتریسیته را از محلول CuSO4 عبور می دهیم تا 20 گرم مس رسوب کند. چه مقدار بار (برحسب کولن) از محلول عبور کرده است؟
چون تغییر عدد اکسایش، وقتی Cu2+ کاهیده می شود، برابر با 2 است، وزن هم ارز مس نصف وزن اتمی آن است، یعنی 31/8 .
مثال:
جریانی به شدت 2 آمپر به مدت 6 ساعت از محلول AgNO3 عبور می کند. چه وزنی از نقره رسوب می کند؟
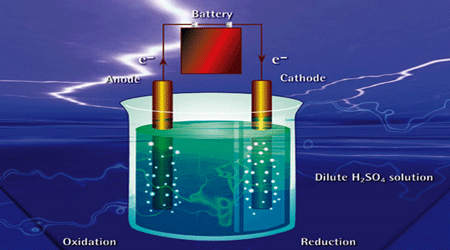
چون یک فاراده الکتریسیته یک هم ارز از هر عنصر را رسوب می د هد، پس نسبت وزن رسوب عنصر اول به ازای مقدار معینی الکتریسیته به وزن رسوب عنصر دوم به ازای همان مقدار الکتریسیته برابر با نسبت وزن هم ارز عنصر اول به وزن هم ارز عنصر دوم است.
وزن هم ارز نقره در AgNO3 برابر با 107/9 است. وزن هم ارز مس در CuSO4 برابر با 31/8 است. بنابراین،
محلولی از CuSO4 را با استفاده از الکترودهای پلاتین الکترولیز می کنیم. 6 لیتر گاز O2 در شرایط STP در الکترود مثبت آزاد می شود. چه وزنی از مس در الکترود منفی رسوب می کند؟
تعداد هم ارزهای O2 آزاد شده در الکترود مثبت با تعداد هم ارزهای Cu رسوب کرده در الکترود منفی برابر است .
4 هم ارز = یک مول O2
فرمول شیمیایی نمک پتاسیم یک اسید سه تایی از مولیبدن (وزن اتمی مولیبدن=95/95) K2MoOx است. هنگامی که محلول اسیدی K2MoOx را بین الکترودهای پلاتین الکترولیز می کنیم، تنها گاز اکسیژن در الکترود مثبت آزاد می شود و تنها فلز مولیبدن در الکترود منفی رسوب می کند. اگر الکترولیز را تا رسوب کردن 0/3454 گرم از مولیبدن ادامه دهیم، 121 سانتی متر مکعب گاز اکسیژن در شرایز STP آزاد می شود. فرمول نمک را محاسبه کنید.
اگر عدد اکستیش Mo را در MoOx2- بدانیم، می توانیم مقدار x را محاسبه کنیم. چون MoOx2- به فلز Mo کاهیده می شود، تغییر عدد اکسایش Mo طی واکنش برابر با عدد اکسایش Mo در MoOx2- است. وزن هم ارز Mo در این واکنش برابر با وزن اتمی مولیبدن تقسیم بر تغییر عدد اکسایش آن است، وقتی Mo از MoOx2- تشکیل می شود بنابراین اگر وزن هم ارز Mo را در واکنش بالا بدانیم، بر اساس روابط زیر می توانیم مقدار x را محاسبه کنیم.
تعداد هم ارزهای Mo رسوب کرده = تعداد هم ارزهای O2 آزاد شده.
بنابراین عدد اکسایش Mo در MoOx2- برابر با 6 است، در نتیجه 4=x و فرمول ترکیب K2MoO4 است.
منبع:
https://fa.wikipedia.org
مرکز یادگیری سایت تبیان - مرجان سلیمانیان