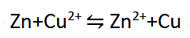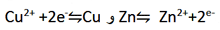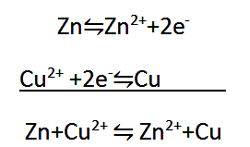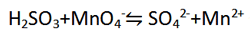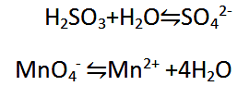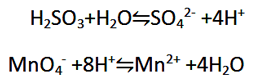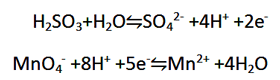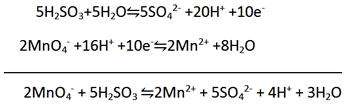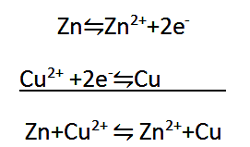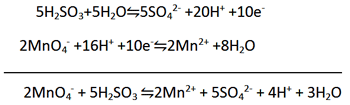حل مسائل اکسایش-کاهش 1
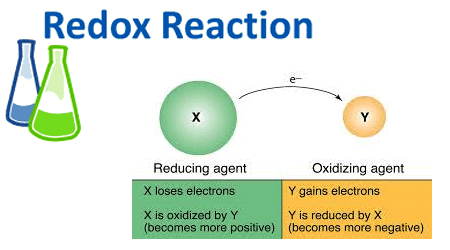
تغییر شیمیایی را که در نتیجه انتقال الکترون رخ می دهدف واکنش اکسایش-کاهش (یا ردکس) می نامند.
اکسایش نتیجه از دست دادن الکترون و کاهش نتیجه به دست آوردن الکترون می باشد. اگرچه هیچ یک از واکنش های اکسایش یا کاهش بدون دیگری رخ نمی دهد، وقتی ماده ای اکسید می شود، ماده دیگر کاهش می یابد. ماده ای که اکسید شده است، رابط کاهنده نام دارد. وقتی ماده ای کاهش می یابد، ماده دیگر اکسید می شود. ماده ای که کاهش می یابد رابط اکسنده نام دارد.
مایکل فارادی فیزیک دان و شیمی دان انگلیسی که کشف بنزن و تهیه ی کلر مایع دز شیمی و ساخت موتور الکتریکی و دینام در فیزیک تنها بخشی از افتخارات او است، علاقه ی زیادی به شیمی، الکتریسیته و رابط هی بین این دو داشت. این علاقه و تلاش فارادی باعث شد که شاخ های از علوم به نام الکتروشیمی ایجاد شود. الکترون پیوند دهنده ی شیمی و الکتریسیته است.
عدد اکسایش: مقدار باری است که یک اتم در یک ذره بدست می آورد هرگاه کلیه پیوندهای موجود در مولکول یونی باشند.
در مطلب قبل تا حدودی با موازنه واکنشهای اکسایش ـ کاهش و روش نیم- واکنش ها آشنا شده اید، حال توضیحاتی برای حل مسائل مربوط به فرایندهای اکسایش-کاهش برای شما مطرح خواهیم کرد.
هر واکنش اکسایش-کاهش را می توانیم مجموع دو نیم واکنش در نظر بگیریم. بنابراین، واکنش کلی زیر :
مجموع دو نیم واکنش زیر می باشد.
نیم واکنش( Half-reaction) مفهومیست در الکتروشیمی که بیان کننده یک واکنش شیمیایی است که طی آن الکترون آزاد توسط مواد گرفته و یا آزاد میشود و طی آن فرایند اکسایش و یا کاهش (احیا) صورت میگیرد. مواد شرکت کننده در نیم واکنشها به صورت یونهای با بار مثبت با منفی نشان داده میشوند.
(توجه کنید که هر یک از نیم واکنش های بالا، مانند تمام نیم واکنش ها، از لحاظ تعداد اتم ها و بار خالص موازنه است، موازنه بار در هر نیم واکنش با استفاده از الکترون انجام می شود. حضور الکترون ها در یک معادله بدین معنی است که آن معادله یک نیم واکنش می باشد.)
در نیم واکنش اول، هر اتم Zn با از دست دادن دو الکترون به یون Zn2+ اکسید می شود. در حقیقت، الکترون های از دست رفته دلیلی بر این واقعیت می باشند که اکسایش رخ داده است. اکسایش را می توان به عنوان واکنشی تعریف کرد که در آن الکترون از دست می رود. در نیم واکنش دوم، هر یون Cu2+ با گرفتن دو الکترون به اتم Cu کاهش می یابد. در حقیقت، گرفتن الکترون دلیلی برای کاهش می باشد. کاهش را می توان به عنوان واکنشی تعریف کرد که در آن الکترون گرفته می شود.
هنگامی که دو نیم واکنش مربوط به یک معادله اکسایش-کاهش را با هم جمع می کنیدف معادله موازنه شده نهایی به دست می آید.
توجه کنید که در این فرایند جمع کردن، الکترون ها که تعداد آنها در دو طرف یکسان است، حذف می شوند و در معادله موازنه شده نهایی وجود ندارند. دلیل حذف شدن آنها این است که تعداد کل الکترون های از دست رفته در نیم واکنش اول با تعداد کل الکترون های گرفته شده در نیم واکنش دوم برابر می باشد.
نکته: به طور خلاصه، موازنه کردن با استفاده از این روش شامل سه مرحله می باشد که عبارت اند از:
1- معادله اولیه موازنه نشده را به دو نیم واکنش اولیه موازنه نشده تفکیک می کنیم.
2- هر نیم واکنش را موازنه می کنیم. .(هر معادله اکسایش-کاهش مجموع دو نیم واکنش موازنه شده است.)
3- با جمع کردن دو نیم واکنش موازنه شده، واکنش اکسایش-کاهش موازنه شده نهایی را به دست می آوریم، برای انجام این عملف هر نیم واکنش موازنه شده را در صورت نیاز در یک ضریب ضرب می کنیم تا به این ترتیب، تعداد کل الکترون های از دست رفته در نیم واکنش اول با تعداد کل الکترون های گرفته شده در نیم واکنش دوم برابر شودف در نتیجه تمام الکترون ها حذف شده، در معادله موازنه شده ظاهر نمی شوند. (اگر الکترونی در معادله نهایی وجود داشته باشد، آن معادله نادرست می باشد.)
مثال: معادله زیر (در محلول اسیدی) را موازنه کنید.
مرحله 1: دو نیم واکنش اولیه را بنویسید.
(عامل کاهنده، H2SO3 به SO42- اکسید می شود.)
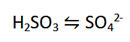
(عامل اکسنده، MnO4- به Mn2+ کاهش می یابد.)
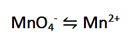
مرحله 2: هر نیم واکنش را موازنه کنید.
الف) برای موازنه H2O، O اضافه کنید.
ب) برای موازنه کردن H به آن H+ اضافه کنید
مرحله 3: دو نیم واکنش را با یکدیگذ جمع کنید. چون در نیم واکنش اول دو الکترون از دست رفته، در حالی که در نیم واکنش دوم پنج الکترون گرفته شده است و از آنجایی که 10 کوچک ترین مضرب مشترک بین 2 و 5 می باشد، پس نیم واکنش اول را در 5 و نیم واکنش دوم را در 2 ضرب کنید.
حال اگر این دو معادله را با هم جمع کنید، 10e- از دو طرف معادله حذف خواهد شد. همچنین 16H+ و 5H2O نیز از هر سمت معادله حذف خواهد شد.
وقتی معادله نهایی موازنه شد باید همیشه آن را دقیق بررسی کنید تا مطمئن شوید از نظر جرم و بار الکتریکی موازنه باشد. اگر ضرایب در ساده ترین صورت نباشد، یا اگر گونه های یکسانی در دو سمت معادله وجود داشته باشد معادله موازنه نهایی نمی باشد.
ادامه دارد ....
منبع:
www.shimihome.com
حل مسائل اکسایش-کاهش (2)
مرکز یادگیری سایت تبیان - مرجان سلیمانیان