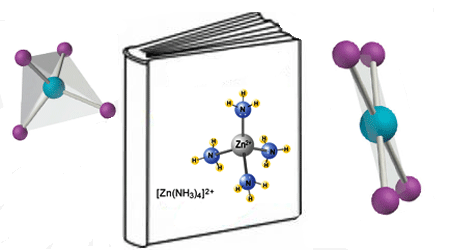
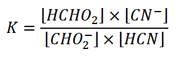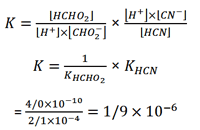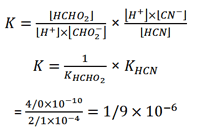انحلال پذیری و یون های کمپلکس
انحلال پذیری به صورت بالاترین مقداری که ماده حل شونده می تواند در مقدار مشخصی از حلال در حالت تعادل، حل شود؛ تعریف می شود.
پیشتر دانستید که یونهای کمپلکس، یونهای چند اتمی هستند که از یک اتم فلزی واقع در مرکز ترکیب و چند یون کوچکتر متصل در اطراف اتم مرکزیکه لیگاند نامیده می شوند، تشکیل شده اند و دانستید که برخی از لیگاندها بیش از یک دندانه دارند! این لیگاندها را چند دندانه ای می نامند که می توانند به انواع مختلفی تجزیه شوند.
می دانید که انحلال پذیری (انحلال پذیری Solubility مفهومی بنیادی در علم شیمی و مبحث محلولهااست که میزان حل شدن یک ماده (جامد،مایع یا گاز) را در یک حلال مشخص (جامد، مایع یا گاز) بیان میکند. ) این کمیت با عواملی چون نوع حلال،دما و فشار رابطه دارد. از درجه"غیر قابل انحلال" مانند لامپ لاوا تا درجه"بسیارقابل انحلال" مانند نمک در آب تقسیم می شود.
انحلال پذیری یک ماده حل شونده، غلظت محلول اشباع شده آن می باشد. (محلول اشباع محلولی است که بالاترین مقدار از ماده حل شونده در حلال در یک دمای مشخص در آن حل شده باشد. و محلول فوق اشباع محلولی است که مقدار ماده حل شده از بالاترین حد انحلال، خیلی بالاتر باشد.)
مواد بر اساس میزان انحلال پذیری در آب تقسیم بندی می شوند. انحلال پذیری یک ماده بیشترین مقدار گرم یک ماده که در دمای معین در 100 گرم آب حل می شود را مشخص می کند.
فرایند انحلال با تغییر انرژی همراه بوده و می تواند گرماده یا گرماگیر باشد. این امر متاثر از رابطه میان حلالیت و دما می باشد و دانستید که فشار، دما و نوع گاز از جمله عواملی هستند که بر انحلال پذیری گازها در آب تاثیرگذارند.
حال حاصل ضرب های انحلال پذیری و یون های کمپلکس را بررسی می کنیم.
هنگامی که محلول اشباع شده شکر را با به هم زدن مقدار اضافی شکر در آب تهیه می کنیم، تعادل زیر برقرار می شود:
مولکول های شکر در محلول ⇋ شکر جامد وقتی یک محلول اشباع شده از نمک کم محلول AgCl را با به هم زدن مقدار اضافی AgCl با آب تهیه می کنیم، نوع دیگری از تعادل برقرار می شود. AgCl نمک است، بنابراین فرض می کنیم که 100% یونیده می شود. در نتیجه، محلول اشباعی که با AgCl جامد در تعادل است، حاوی یون های نقره و یون های کلرید می باشد و نه مولکول های AgCl یونیده نشده. این یون های نقره و یون های کلرید با مقدار اضافی از AgCl جامد در تعادل می باشند بنابر این تعادل موجود در چنین محلول های اشباعی از AgCl را می توان به صورت زیر نشان داد:
وقتی یک محلول اشباع شده از نمک کم محلول AgCl را با به هم زدن مقدار اضافی AgCl با آب تهیه می کنیم، نوع دیگری از تعادل برقرار می شود. AgCl نمک است، بنابراین فرض می کنیم که 100% یونیده می شود. در نتیجه، محلول اشباعی که با AgCl جامد در تعادل است، حاوی یون های نقره و یون های کلرید می باشد و نه مولکول های AgCl یونیده نشده. این یون های نقره و یون های کلرید با مقدار اضافی از AgCl جامد در تعادل می باشند بنابر این تعادل موجود در چنین محلول های اشباعی از AgCl را می توان به صورت زیر نشان داد:
AgCl(s) ⇋ Ag+(aq) + Cl-(aq)
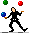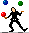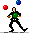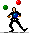 چون این واکنش یک تعادل واقعی است، ثابت تعادل دارد. همان طور که می دانید واکنش دهنده های جامد در معادله تعادل وارد نمی شوند بنابراین، K= [Ag+] × [Cl-]می باشد.
چون این واکنش یک تعادل واقعی است، ثابت تعادل دارد. همان طور که می دانید واکنش دهنده های جامد در معادله تعادل وارد نمی شوند بنابراین، K= [Ag+] × [Cl-]می باشد. این رابطه تنها بیان می کند که حاصل ضرب غلظت های یون های حل شده در محلول اشباع شده یک الکترولیت کم محلول در دمای معین مقداری ثابت است. این مقدار ثابت، K را ثابت حاصل ضرب انحلال پذیری یا به طور ساده تر حاصل ضرب انحلال پذیری می نامند و معمولا با نماد Ksp یا SP نشان می دهند.
اگر حاصل ضرب غلظت یون های نقره و کلرید برحسب مول بر لیتر در محلولی که حاوی این یون ها است، کمتر از Ksp AgCl باشد، رسوب AgCl تشکیل نخواهد شد. از طرف دیگر، اگر حاصل ضرب غلظت های Ag+ و Cl- بزرگ تر از Ksp باشد، نقره کلرید رسوب خواهد کرد، علاوه بر آن AgCl تا زمانی که مقدار کافی یون های Ag+ و یون های Cl- از محلول جدا شوند و حاصل ضرب غلظت آن به مقدار Ksp برسد، به رسوب کردن ادامه خواهد داد.
 حاصل ضرب انحلال پذیری نمونه ای از تعادل یونی را نشان می دهد (مطلب شماره 1). در تمام مسائلی که شامل حاصل ضرب انحلال پذیری است، فرض می کنیم که همه سیستم ها ایده آل هستند و حاصل ضرب انحلال پذیری را دقیقا می توان برحسب تابعی از غلظت های مولی یون های درگیر بیان کرد.
حاصل ضرب انحلال پذیری نمونه ای از تعادل یونی را نشان می دهد (مطلب شماره 1). در تمام مسائلی که شامل حاصل ضرب انحلال پذیری است، فرض می کنیم که همه سیستم ها ایده آل هستند و حاصل ضرب انحلال پذیری را دقیقا می توان برحسب تابعی از غلظت های مولی یون های درگیر بیان کرد.مقادیر ثابت های حاصل ضرب انحلال پذیری را معمولا در دمای 20 درجه سانتی گراد تعیین می کنند. در بسیاری از مسائل محاسبات بر پایه داده هایی انجام می شوند که در دماهایی غیر از 20 درجه سانتی گراد به دست آمده اند.
چون حاصل ضرب انحلال پذیری به دست آمده تابعی از دما و صحت اندازه گیری است، مقدار Ksp یک ماده خالص ممکن است در همه مسائل یکسان نباشد. از انجایی که این امر به هیچ وجه در محاسبات تاثیر نمی گذارد لزومی ندارد که مورد توجه قرار گیرد.
تاکید می کنیم که مفهوم حاصل ضرب انحلال پذیری فقط برای الکترولیت های قوی کم محلول به کار می رود. این مفهوم برای الکترولیت های قوی کاملا محلول نظیر NaCl، MgSO4 و KOH یا الکترولیت های ضعیف، صرف نظر از انحلال پذیری آنها کاربرد ندارد. حاصل ضرب انحلال پذیری را نباید با انحلال پذیری اشتباه کنید. انحلال پذیری یعنی، مقدار ماده حل شده ای که به هنگام تکان دادن جامد خالص با آب خالص در یک دمای معین وارد محلول می شود تا یک محلول اشباع شده به دست آید.
مطلب شماره 1:
سایر تعادل هایی که شامل الکترولیت های ضعیف می باشند.
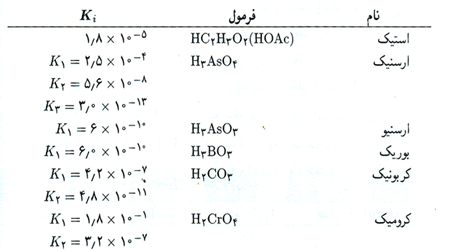
روش تفکیک یک ثابت تعادل خاص به ثابت های سازنده آن را که در محاسبه ثابت های هیدرولیز مورد استفاده قرار می گیرد، می توان برای سایر سیستم ها به کار برد. مثلا، هنگامی که سدیم فرمات، NaCHO2 را به محلولی از هیدروسیانیک اسید اضافه می کنیم، تعادل زیر به وجود می آید:
CHO2- (aq) + HCN (aq) ⇌ HCHO2 (aq) + CN- (aq)
ثابت تعادل این واکنش عبارت است از
با ضرب کردن صورت و مخرج در [H+] داریم
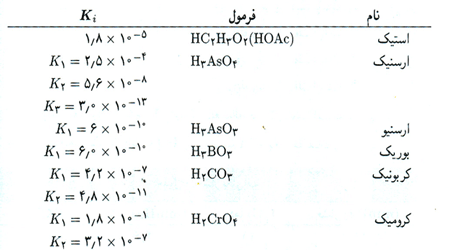
1- جدول ثابت های یونش اسید ها و بازها (روی عکس کلیک کنید.)
2- جدول حاصل ضرب انحلال پذیری در 20 درجه سانتی گراد (روی عکس کلیک کنید.)
مرکز یادگیری سایت تبیان، مرجان سلیمانیان