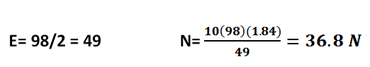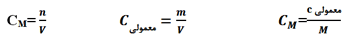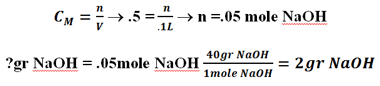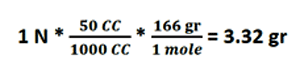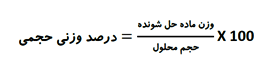روابط محلول سازی (2)
محلول سازی در آزمایشگاه شیمی را به دو دسته (محلول سازی از مایعات و محلول سازی از جامدات) تقسیم بندی می کنند.
در مطلب قبل دانستید که به طور کلی محاسبات محلول سازی برحسب مولاریته یا برحسب نرمالیته می باشد. حال ادامه محلول سازی از مایعات بر حسب غلظت نرمال را بررسی می کنیم.
حجمی را که از محلول مادر برداشتید و محلول سازی را توسط آن انجام دادید بوسیله فرمول زیر حساب کردید:
N1V1 = N2V
|
غلظت محلول مادر |
N1 |
|
V1 | |
|
غلظت مورد نیاز از محلولی که می خواهیم بسازیم |
N2 |
|
حجم مورد نیاز از محلولی که می خواهیم بسازیم |
V2 |
مثال: 100 میلی لیتر اسید سولفوریک 2 نرمال تهیه کنید:
همان طور که می دانیم در ابتدا با استفاده از لیبل باید غلظت محلول مادر را حساب کنیم که در اینجا بجای آوردن لیبل اطلاعاتش را در اختیار داریم:
d = 1.84 g/cm3 - M = 98 g/mole - % Purity = 98
پس غلظت محلول غلیظ اسید سولفوریک 8/36 نرمال است، حالا حجمی که باید از محلول غلیظ اسید سولفوریک برداریم را حساب می کنیم:
N1V1 = N2V = 36.8 V1 = 2 (100) ➝ V1 = 5.43 ml or cc
یعنی مقدار 5/43 میلی لیتر از اسید برمی داریم و داخل بالون ژوژه می ریزیم و به حجم 100 میلی لیتر می رسانیم.
2 - الف) محلول سازی از جامدات بر حسب غلظت مولار
در این نوع محلول سازی دیگر کمیت های درصد خلوص و دانسیته مطرح نیست و در این قسمت از روابط غلظت مولار و غلظت معمولی بهره می گیریم.
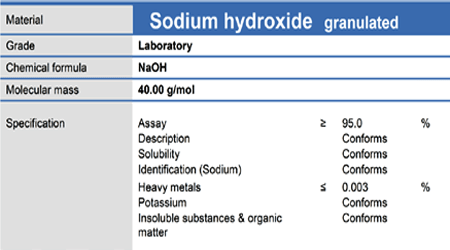
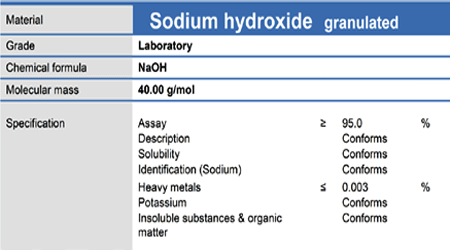
در اینجا ما فقط به جرم مولکولی ترکیب احتیاج داریم که آن را ، هم می توانیم از روی لیبل جامد ببینیم و هم خودمان می توانیم حساب کنیم. در ادامه یک نمونه لیبل ماده جامد را هم خواهیم دید.
یعنی 2 گرم از سدیم هیدروکسید (جامد) برمی داریم و در بالون 100 میلی لیتری به حجم می رسانیم.
2- ب) محلول سازی از جامدات بر حسب غلظت نرمال
اگر بخواهیم از جامدی، محلول تهیه کنیم که غلظت آن را بر حسب مولار بیان کرده اند به شیوه زیر عمل می کنیم:
مطلوب است تهیه 50 سی سی محلول یک نرمال یدید پتاسیم، مثال:
MW KI = 166 gr/mole
32/3 گرم باید از پتاسیم یدید برداریم و در بالون به حجم 50 سی سی برسانیم.
تذکر: واحد سی سی فرقی با میلی لیتر ندارد.
تذکر عملیاتی: در محلول سازی جامد ابتدا جامد را داخل بالون بریزید و با کمی آب مقطر ابتدا جامد را خوب حل کنید و سپس به حجم برسانید.
نکته: اگر بخواهیم نرمالیته را به مولاریته تبدیل کنیم و محلول سازی از جامدات را بر اساس قوانین مولاریته انجام دهیم از فرمول زیر استفاده می کنیم.
تا اینجا محلول سازی را به شکل های رایج و معمول یاد گرفتیم ، اما بعضی اوقات در آزمایشگاه ممکن است به شکل های دیگری از محلول سازی بر بخوریم که شاید طریقه ساخت این نوع از محلول ها را ندانیم. به طور مثال محلول هایی که غظت آنها بر حسب مولال، v/v ، w/w ، w/v و یا حتی ppm مطرح شود.
در مطلب قبل دانستید که بسیاری از واکنش ها در حالت محلول انجام می شوند و محاسبه های کمی برای این گونه واکنش ها بر مبنای غلظت آن ها صورت می گیرد. یکی از روش های بیان غلظت، درصد جرمی (وزنی) می باشد و در مطلب بعدی با روش غلظت مولال در شیمی محلول ها آشنا شده اید.
در مطلبی دیگر دانستید زمانی که در آزمایشگاه محلولی از دو مایع قابل امتزاج مانند آب و الکل یا آب و استون ( مایع هایی که به هر نسبت با هم مخلوط می شوند) تهیه می کنید، ساده ترین راه برای بیان غلظت آن استفاده از درصد حجمی می باشد، حال با درصد وزنی حجمی w/v آسنا می شویم.
درصد وزنی حجمی w/v
از این آیتم بیشتر برای جامدات استفاده می شود.
مثال: مطلوبست تهیه 100 میلی لیتر محلول 10 % وزنی حجمی هیدروکسیل آمین:
هیدروکسیل آمین یک ماده جامد است ، می توانیم 10 گرم از این جامد را برداریم و به حجم 100میلی لیتر برسانیم.
ادامه دارد ...
روابط محلول سازی (1)
روابط محلول سازی (3)
بخش مرکز یادگیری سایت تبیان - مرجان سلیمانیان