هیدروژن

خصوصیات قابل توجه
هیدروژن سبک ترین عنصر شیمیایی بوده با معمول ترین ایزوتوپ آن که شامل تنها یک پروتون و الکترون است. در شرایط فشار و دمای استاندارد هیدروژن یک گاز،H2، دو اتمی با نقطه جوش 20.27° K و نقطه ذوب 14.02° K را می سازد. در صورتی که این گاز تحت فشار فوق العاده بالایی، مانند شرایطی که در مرکز غول های گازی وجود دارد، قرار گیرد مولکول ها ماهیت خود را از دست داده و هیدروژن به صورت فلزی مایع در می آید. اما در فشار های بسیار پایین مانند شرایطی که در فضا یافت می شود، به این علت که هیچ راهی برای ترکیب اتم هایش وجود ندارد، هیدروژن تمایل دارد تا به صورت اتم های مجزا در آمده؛ ابرهای H2 (هیدروژنی) تشکیل می شود که به شکل گیری ستارگان نیز مرتبط می باشد.
این عنصر نقش بسیار حیاتی در تامین انرژی جهان از طریق واکنش پروتون-پروتون و چرخه کربن-نیتروژن به عهده دارد ( این ها فرآیندهای هم جوشی هسته ای هستند که با ترکیب دو اتم هیدروژن به یک اتم هلیم، مقدار بسیار عظیمی از انرژی آزاد می کنند. )
کاربردها
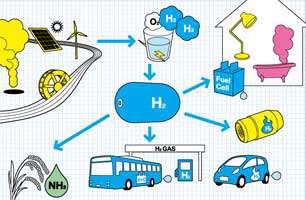
به مقدار بسیار زیادی هیدروژن در فرآیند هابر (Haber Process) صنعت نیاز می باشد، مقدار قابل توجهی در برای تولید آمونیاک، هیدروژنه کردن چربی ها و روغن ها، و تولید متانول. سایر مواردی که نیازمند هیدروژن است عبارتند از:
- هیدرودیلکیلاسیون(hydrodealkylation)،
- هیدرودیسولفوریزاسیون (hydrodesulfurization) و هیدروکرکینک (hydrocracking)
- تولید اسید هیدروکلریک، جوشکاری،سوخت های موشک و احیاء سنگ معدن فلزی
- هیدروژن مایع در تحقیقات سرما شناسی مانند مطالعات ابررسانایی به کار می رود.
- تریتیوم که در رآکتورهای اتمی تولید می شود در ساخت بمب های هیدروژنی مورد استفاده قرار می گیرد.
- هیدروژن چهارده و نیم بار از هوا سبک تر است و سابقا به عنوان عامل بالا برنده در بالون ها و کشتی های هوایی مورد استفاده قرار می گرفت تا وقتیکه فاجعه هیندنبرگ ثابت کرد که استفاده از این گاز برای این منظور بسیار خطرناک است.
- دوتریوم به عنوان یک کند کننده جهت کاهش حرکت نوترون ها در فعالیت های هسته ای مورد استفاده قرار می گیرد، و ترکیبات دوتریوم در شیمی و زیست شناسی در مطالعات تاثیرات ایزوتوپ، مورد استفاده وافع می شوند.
- تریتیوم که یک ایزوتوپ طبقه بندی شده در علوم زیست شناسی است که به عنوان یک منبع تشعشع در رنگ های نورانی کاربرد دارد.
هیدروژن می تواند در موتورهای درون سوز سوخته شود و در برهه کوتاهی اتومبیل هایی با سوخت هیدروژنی توسط شرکت Chrysler-BMW تولید شدند. پیل های سوختی هیدروژنی، به عنوان راه کاری برای تولید توان بالقوه ارزان و بدون آلودگی، مورد توجه قرار گرفته است.
تاریخچه
هیدروژن «فرانسه به معنی سازنده آب و واژه یونانی hudôr یعنی "آب" و gennen یعنی "تولید کننده") برای اولین بار در سال 1776 بوسیله هنری کاوندیش به عنوان یک ماده مستقل شناخته شده، آنتونی لاوازیه نام هیدروژن را برای این عنصر انتخاب کرد.
پیدایش
هیدروژن فراوان ترین عنصر در جهان است به طوریکه 75% جرم مواد طبیعی از این عنصر ساخته شده و بیش از 90% اتم های تشکیل دهنده آن ها اتم های هیدروژن است.
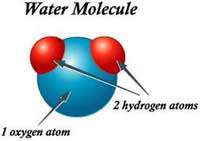
این عنصر به مقدار زیاد و به وفور در ستارگان و سیارات غول های گازی یافت می شود. به نسبت فراوانی زیاد آن در جاهای دیگر، هیدروژن در اتمسفر زمین بسیار رقیق است(1 ppm برحسب حجم). متعارف ترین منبع برای این عنصر در زمین آب است که از دو قسمت هیدروژن و یک قسمت اکسیژن (H2O) ساخته شده است.
منابع دیگر عبارتند از بیشترین اشکال مواد آلی که در اندام تمام موجودات زنده شناخته شده وجود دارند، زغال، سوخت فسیلی و گاز طبیعی. متان ( CH4)، که یکی از محصولات فرعی فساد ترکیبات آلی است که اهمیت منابع آن رو به افزایش است.
هیدروژن از چندین راه مختلف به دست می آید، عبور بخار از روی کربن داغ، تجزیه هیدروکربن به وسیله حرارت، واکنش هیدروکسید سدیم یا پتاسیم بر آلومینیوم، الکترولیز آب یا از جابجایی آن در اسیدها توسط فلزات خاص.
هیدروژن تجاری در حجم های زیاد معمولا به وسیله تجزیه گاز طبیعی تولید می شود.
ترکیبات
هیدروژن سبک ترین گازها با اکثر عناصر ترکیب شده و ترکیبات مختلف را به وجود می آورد. هیدروژن دارای عدد اکترونگاتیویته 2.2 است پس هیدروژن هنگامی ترکیبات را می سازد که عناصر غیر فلزی تر و عناصر فلزی تری وجود داشته باشند. در این حالت(غیر فلزی) تشکیل دهنده ها هیدریدها نامیده می شوند، که هیدروژن یا به صورت یون های - H یا به صورت حل شده در عنصر دیگر وجود خواهد داشت (مانند هیدرید پالادیوم). در حالت دوم (ترکیب با فلز) هیدروژن تمایل برای تشکیل پیوند کووالانسی دارد، چون یون های+ H بصورت یک اتم عریان فاقد الکترون در می آیند بنابراین تمایل شدیدی به جذب الکترون ها به سمت خود داردند. هر دوی این ها تولید اسید می کنند. لذا حتی در یک محلول اسیدی می توان یون هایی مثل+ H3O را دید که گویی پروتون ها به جایی محکم به چیزی چسبیده اند.
هیدروژن با اکسیژن ترکیب شده و تولید آب می کند، H2O، که در این واکنش مقدار زیادی انرژی را به صورتی آزاد می کند که، باعث انفجار در هوا می گردد. به اکسید دوتریوم یا D2O، که معمولا آب سنگین گفته می شود. همچنین هیدروژن با کربن یک سری ترکیبات گسترده ای را به وجود می آورد. به خاطر ارتباط این ترکیبات با چیزهای زنده، این ترکیبات را ترکیبات آلی می نامند، و به مطالعه خصوصیات این ترکیبات شیمی آلی گفته می شود.
حالت ها
در شرایط عادی گاز هیدروژن ترکیبی از دو نوع متمایز مولکول است که با هم از نظر جهت چرخش الکترونها و هسته تفاوت دارند. این دو شکل به نام ارتو- و پارا- هیدروژن معروفند. (این مورد با ایزوتوپ ها فرق می کند به پاراگراف بعد توجه کنید.) در شرایط استاندارد هیدروژن معمولی ترکیبی از 25% شکل پاراو 75% شکل ارتو است. شکل ارتو را نمی توان به صورت حالت خالص آن تهیه کرد. این دو مدل هیدروژن از نظر انرژی با هم متفاوتند که این مسئله موجب می گردد، تا خصوصیات فیزیکی آن ها کمی متفاوت باشد. مثلا نقطه ذوب و جوش پاراهیدروژن تقریبا 0.1 K ° پایین تر از ارتوهیدروژن است. (به اصطلاح شکل عادی.)
ایزوتوپ ها
پروتیوم، معمولی ترین ایزوتوپ هیدروژن فاقد نوترون است گرچه دو ایزوتوپ دیگر به نام دوتریوم دارای یک نوترون و تریتیوم رادیو اکتیویته دارای دو نوترون، وجود دارند. دو ایزوتوپ پایدار هیدروژن پروتیوم (H-1) و دیتریوم (D ، H-2) می باشند. دیتریوم شامل 0.0184-0.0082% درصد کل هیدروژن است «IUPAC)؛ نسبت های دیتریوم به پروتیوم با توجه به استاندارد مرجع آب VSMOW اعلام می گردد. تریتیوم(T یا H-3)، یک ایزوتوپ رادیواکتیو دارای یک پرتون و دو نوترون می باشد. هیدروژن تنها عنصری است که ایزوتوپ های آن اسمی مختلفی دارند.
هشدارها
هیدروژن گازی است با قدرت اشتعال فوق العاده زیاد. این گاز همچنین به شدت با کلر و فلوئور واکنش نشان می هد. D2O، یا آب سنگین برای بسیاری از گونه های سمی است. اما مقدار قابل توجهی از آن برای کشتن انسان لازم است.

















