قوانین گازها در ترمودینامیک
انرژی درونی چیست؟
انرژی درونی، انرژی در مقیاس اتمی و مولکولی و ناشی از حرکت تصادفی و نامنظم مولکول ها می باشد. برای مثال، یک لیوان آب با دمای ثابت که روی میز قرار گرفته، هیچ گونه انرژی پتانسیل و جنبشی ندارد. اما اگر در مقیاس میکروسکوپی بنگریم، مجموعه ای از مولکول هایی است که با سرعت بالا، صدها متر در ثانیه جا به جا می شوند.
انرژی جنبشی میکروسکوپی بخشی از انرژی درونی است.
نیروهای جاذبه ی بین مولکولی با انرژی پتانسیل مرتبط اند.
در مقیاس ماکروسکوپی یک لیوان آب هیچ انرژی ظاهری ندارد.
سوال: آیا یک لیوان آب روی میز انرژی دارد؟
بنابراین حالا می توانیم انرژی درونی یک گرم آب و یک گرم مس را در دمای ثابت مقایسه کنیم. همان طور که می دانید گرمای ویژه ی آب و فلزات متفاوت است. گرمای ویژه بخشی از انرژی درونی است. اگر دماها یکسان باشند، میانگین انرژی جنبشی یکسان خواهد بود، این نیز بخشی از انرژی درونی است.
دقیقا انرژی جنبشی انتقالی یکسان است. ( انرژی جنبشی چرخشی و ارتعاشی در این مثال حذف شده اند.)
چگالی چیست؟ چگونه به حجم مربوط می شود؟
چگالی میزان جرم به ازاء واحد حجم می باشد. هر مولکول جرم دارد. بنابراین هر چه تعداد مولکول ها در یک حجم ثابت بیشتر باشد، چگالی بیشتر است.
واحد چگالی که آن را با P نشان می دهیم، کیلوگرم بر متر مکعب (kg/m3) است.
گاز ایده آل:
این جا شما می توانید قانون گاز ایده آل را ملاحظه کنید.
|
|
برای دریافت فایل آموزشی کلیک نمایید.
P فشار، v حجم، n تعداد مول، ، T دما، و R= 8.31 J/(mol.k) ثابت قانون گاز ایده آل می باشند.
در این محتوای تعاملی، n=1 و T=300oK در نظر گرفته شده است، شما می توانید با کلیک روی pressure و volume این مقادیر را در طول آزمایش تغییر دهید و در قسمت راست این فایل آموزشی نمودار حجم- فشار این گاز را مشاهده نمایید.
با توجه به این که شما متغیرهای ترمودینامیکی را تغییر می دهید، آیا می توانید قانون گازها را بیان کنید؟
کار چیست؟
کار انجام شده توسط یک سیستم، به فشار و تغییرات حجم در دمای ثابت وابسته است. کار به صورت نیرو، ضرب در فاصله (مسافت طی شده) هم تعریف می شود، پس واحد آن ژول یا نیوتون × متر یا (kg.m2)/s2 است.
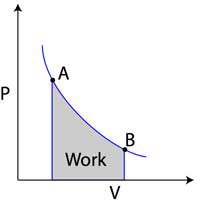
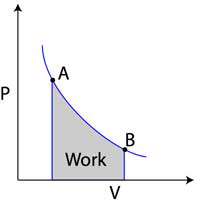
خط کشیده شده از A به B نشان دهنده انبساط گاز در دمای ثابت است. کار انجام شده معادل مساحت زیر نمودار می باشد.
در گذار از نقطه A به نقطه B، حجم گاز افزایش یافته در حالی که فشار گاز کاهش یافته است. بالعکس در گذار از نقطه B به نقطه A حجم کاهش یافته در حالی که فشار افزایش یافته است. فرمول محاسبه کار به صورت W=-PΔV است. با محاسبه مساحت سطح زیر نمودار فشار حجم، شما می توانید به مقدار کار دست یابید. اگر حجم گاز ایده آل افزایش پیدا کرد، کار انجام شده بر گاز منفی است ولی اگر گاز فشرده شده باشد و حجمش کمتر شده باشد، کار انجام شده بر گاز مثبت است.
مرکز یادگیری سایت تبیان