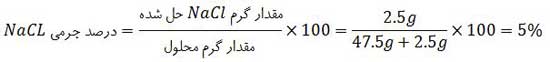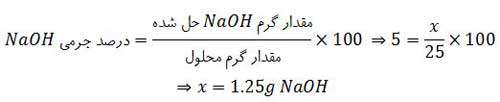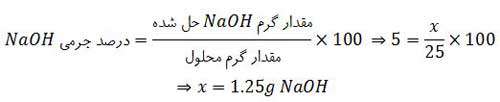درصد جرمی
چکیده:
یکی از مباحث بسیار مهم در فصل محلول ها غلظت می باشد. معمولا برای کار در آزمایشگاه ها از محلول های استاندارد استفاده می کنند. محلولی را استاندارد می گویند که در آن، رابطه بین مقادیر ماده حلشده و محلول یا رابطه بین مقدار ماده حلشده و حلال به نحوی معلوم باشد. با معلوم بودن مقدار ماده حلشونده و مقدار حلال تشکیل دهنده محلول، غلظت محلول مشخص میگردد. برای بیان غلظت محلول ها روش های مختلفی وجود دارد. در این درس و درس های بعد به بررسی این هر یک از این روش ها و مسائل پیرامون آن ها خواهیم پرداخت. با ما همراه باشید.
شرح درس:
غلظت یک محلول به صورت مقدار ماده حل شونده در مقدار معینی حلال یا مقدار ماده حل شونده موجود در مقدار معینی محلول تعریف می شود. بسیاری از واکنش ها در حالت محلول انجام می شوند و محاسبه های کمی برای این گونه واکنش ها بر مبنای غلظت آن ها صورت می گیرد. یکی از روش های بیان غلظت، درصد جرمی (وزنی) می باشد.
به مقدار گرم ماده حل شونده موجود در 100 گرم از یک محلول، درصد جرمی ماده حل شونده در آن محلول گفته می شود.
برای محاسبه درصد جرمی ماده حل شونده در یک محلول، می توان از رابطه زیر استفاده کرد:
نکته: یکای جرم در صورت و مخرج کسر باید یکسان باشد. یعنی هر دو باید برحسب میلی گرم، گرم یا کیلوگرم بیان شوند.
درصد جرمی را با نماد w/w نشان می دهند.
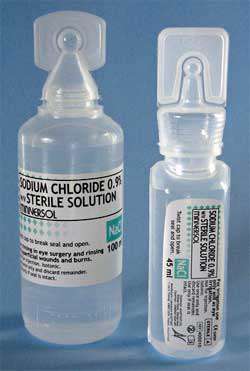
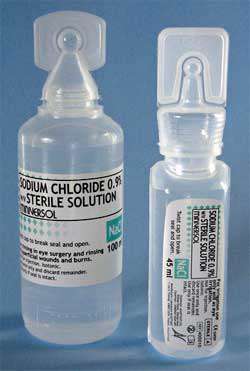
روی بر چسب محلول شست وشوی دهان نوشته می شود: "محلول استریل سدیم کلرید 0.9 درصد برای شستشو". عبارت "سدیم کلرید 0.9 درصد" یعنی در 100 گرم از این محلول 0.9 گرم سدیم کلرید وجود دارد و بقیه آن آب است.
نکته: برای تبدیل درصد جرمی به غلظت معمولی می توان از رابطه زیر استفاده کرد:
C : غلظت معمولی ( بر حسب g.L-1)
a : درصد جرمی ( بدون مخرج 100)
d : چگالی ( بر حسب g.ml-1)
مثال: اگر درصد جرمی ٢/٥ گرم سدیم کلرید در ٤٧/٥ گرم آب با درصد جرمی سدیم هیدروکسید در یک نمونه از محلول آن برابر باشد، در ٢٥ گرم از این نمونه محلول سدیم هیدروکسید، چند گرم از آن وجود دارد؟
حل:
درصد جرمی محلول NaOH با درصد جرمی محلول NaCl ، مساوی فرض شده است و در مورد محلول NaOH می توان نوشت:
مرکز یادگیری سایت تبیان – تهیه و تنظیم: مهسا شاه حسینی