
انحلال مواد در آب
چکیده: ب
عد از بررسی تشکیل محلول ها، به انحلال چند ماده مهم و مطرح شده در کتاب می پردازیم.
شرح درس:
انحلال اتانول در آب:
زمانی که اتانول در آب حل می شود، پیوند هیدروژنی قوی بین مولکول های آب و اتانول ایجاد می شود که از پیوند هیدروژنی میان مولکول های آب و پیوند هیدروژنی میان مولکول های اتانول قوی تر بوده و می تواند بر آن ها غلبه کند و سبب پیشرفت انحلال اتانول در آب شود.
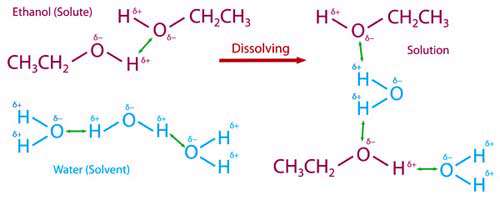
گروه اتیل (- C2H5 ) در اتانول الکترون دهنده است و اکسیژن موجود در اتانول را از لحاظ الکترونی تغذیه می کند. این امر سبب می شود اکسیژن دارای جزیی بار منفی شده و بتواند با اتم های هیدروژن مولکول های آب که دارای جزیی بار مثبت هستند پیوند هیدروژنی قوی برقرار کند.
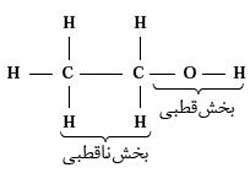
• در اتانول بخش قطبی بر بخش ناقطبی غلبه کرده و سبب انحلال آن در مولکول های قطبی آب می شود.
انحلال بوتانول در آب:
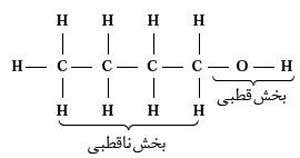
در مولکول 1-بوتانول بخش ناقطبی بخش بیشتری از مولکول را تشکیل می دهد و بر هم کنش های بین مولکولی از سمت بخش ناقطبی افزایش می یابد. به همین دلیل 1- بوتانول در مقایسه با اتانول به مقدار کمتری در آب حل می شود.
ویتامین A (رتینول): ویتامین C (آسکوربیک اسید): نکته: در مولکول هایی مانند ویتامین C یا ویتامین A باید توجه داشت که قسمت های هیدروکربنی بخش ناقطبی مولکول و قسمت های اکسیژن دار بخش قطبی مولکول محسوب می شوند. مرکز یادگیری سایت تبیان – تهیه و تنظیم: مهسا شاه حسینی
نکته: هرچه بر طول زنجیره هیدروکربنی الکل های راست زنجیر افزوده شود بخش ناقطبی مولکول بزرگتر شده و انحلال پذیری آن در آب کمتر می شود.
در ویتامین A تنها یک پیوند O-H به عنوان بخش قطبی مولکول وجود داشته و بخش ناقطبی بسیار بزرگتر است. به همین دلیل ویتامین A در آب حل نمی شود اما در چربی که حلال ناقطبی است حل شدنی می باشد.
همان طور که در شکل می بینید در این ماده بخش های قطبی بیشتر بوده و می توانند بر بخش ناقطبی مولکول غلبه کنند، در نتیجه ویتامین C در آب حل می شود اما در حلال های ناقطبی مانند چربی حل نشدنی است.
توجه: مصرف بیش از اندازه ویتامین A می تواند برای بدن مشکل ساز شود زیرا این ویتامین در بافت های چربی بدن ذخیره می شود اما ویتامین C در آب حل شده و مقادیر زیاد آن دفع می شود بنابراین مصرف بیش از اندازه آن برای بدن مشکلی ایجاد نخواهد کرد.

















