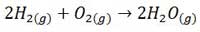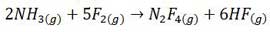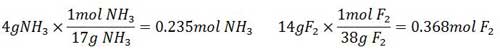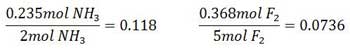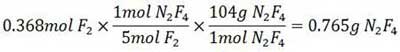واکنش دهنده محدود کننده و واکنش دهنده اضافی
چکیده: در درس های قبل به انواع واکنش ها و روابط کمی میان واکنش دهنده ها پرداختیم، اما یکی از مباحث مهم در موضوع استوکیومتری، واکنش دهنده محدودکننده و واکنش دهنده اضافی است که موضوع این درس می باشد.
شرح درس:
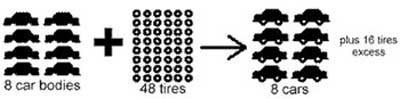
در هنگام اجرای واکنش های شیمیایی در صنعت یا طبیعت، معمولا واکنش دهنده ها درست به اندازه نسبت های استوکیومتری در مجاورت یکدیگر قرار نمی گیرند. معمولا یکی از واکنش دهنده ها به مقدار کمتری از مقدار استوکیومتری مورد نیاز در واکنش به کار برده می شود و در جریان واکنش زودتر از واکنش دهنده های دیگر به مصرف می رسد. این واکنش دهنده که از این طریق مقدار پیشرفت واکنش و مقدار فراورده های تولید شده را با محدودیت رو به رو می کند، واکنش دهنده محدود کننده نامیده می شود. واکنش دهنده ای که بیشتر از مقادیر استوکیومتری مورد نیاز واکنش به کار برده می شود و در پایان واکنش، مقداری از آن اضافی باقی بماند، واکنش دهنده اضافی نام دارد.
• واکنش دهنده ای محدود کننده است که پیشرفت یک واکنش شیمیایی را تعیین می کند به طوریکه با تمام شدن این نوع واکنش دهنده، واکنش به پایان می رسد.
واکنش زیر را در نظر بگیرید. در این واکنش همواره 2 مول گاز هیدروژن با 1 مول گاز اکسیژن به طور کامل ترکیب می شود.
تشخیص واکنش دهنده محدود کننده در مسائل:
توجه: اگر اطلاعات داده شده در صورت مساله راجع به دو ماده واکنش دهنده بود و مقدار یکی از فراورده ها را خواسته بودند، با بحث محدودکننده مواجه هستیم. برای تشخیص واکنش دهنده محدودکننده در مسایل، می توان به شیوه های گوناگونی عمل کرد.
روش اول:
گام نخست: تبدیل جرم یا حجم واکنش دهنده ها به تعداد مول آن ها
گام دوم: تقسیم تعداد مول هر یک از واکنش دهنده ها به ضریب استوکیومتری آن ها در معادله موازنه شده
هر واکنش دهنده ای که این نسبت برای آن عدد کوچکتری باشد، محدود کننده است.
روش دوم:
گام نخست: تبدیل جرم یا حجم واکنش دهنده ها به مول
گام دوم: انتخاب یک واکنش دهنده به عنوان واکنش دهنده فرضی و محاسبه مقدار لازم از واکنش دهنده های دیگر
گام سوم: مقایسه مقدار مورد نیاز محاسبه شده از واکنش دهنده دیگر با مقدار داده شده در مساله
اگر مقدار محاسبه شده مورد نیاز برای هر یک از واکنش دهنده ها کمتر از مقدار داده شده در مساله باشد، انتخاب واکنش دهنده محدودکننده درست بوده است. در صورتی که برای یکی از واکنش دهنده ها مقدار داده شده در مساله کمتر از مقدار محاسبه شده موردنیاز باشد، این واکنش دهنده محدود کننده است و باید محاسبه ها را بر پایه آن انجام داد.
مثال: چند گرم N2 F4 را می توان از لحاظ نظری از ٤ گرم NH3 و ١٤ گرم F2 بدست آورد؟
حل: نخست باید واکنش دهنده محدود کننده را بیابیم. برای این کار تعداد مول های موجود هر واکنش دهنده را می یابیم. وزن مولکولی NH3 ، ١٧ و وزن مولکولی F2، ٣٨است.
سپس تعداد مول هریک از واکنش دهنده ها را به ضریب استوکیومتری آن ها در معادله موازنه شده تقسیم می کنیم.
از آن جا که مقدار این نسبت برای F2 کمتر است، F2 واکنش دهنده محدودکننده بوده و مساله را بر مبنای مقدار F2 موجود حل می کنیم. وزن مولکولی N2 F4 ،١٠٤ است و به ازای مصرف ٥ مول F2، یک مول N2 F4 تولید می شود.
مرکز یادگیری سایت تبیان - تهیه و تنظیم: مهسا شاه حسینی