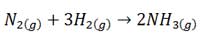قانون نسبت های ترکیبی و قانون آووگادرو
چکیده: به دنبال بحث پیرامون حل مسائل عمومی استوکیومتری مربوط به گازها، لازم است به دو قانون مهم در محاسبات حجمی در گازها اشاره کنیم. با ما همراه باشید.
شرح درس:
قانون نسبت های ترکیبی:
آزمایش های شیمی دان و فیزیکدان فرانسوی، ژوزف لویی گی لوساک، محاسبات حجمی در گازها را بنا نهاد و نتایج آزمایشات او منجر به معرفی قانون نسبت های ترکیبی گردید. براساس این قانون، در دما و فشار ثابت، گازها در نسبت های حجمی معینی با هم واکنش می کنند.
این نسبت های حجمی به طور مستقیم با نسبت ضرایب این گازها در معادله موازنه شده واکنش متناسب هستند. به عنوان مثال در واکنش مربوط به تشکیل آمونیاک یک مول گاز N2 با سه مول گاز H2 واکنش می دهد و دو مول گاز NH3 تولید می کند.
طبق قانون نسبت های ترکیبی گی لوساک می توان به جای نسبت مولی، نسبت حجمی گازها را بیان کرد و این گونه عنوان نمود که یک حجم گاز N2 با سه حجم گاز H2 واکنش داده و تولید دو حجم گاز NH3 می کنند.
قانون آووگادرو:
برای نخستین بار آووگادرو در سال 1811 دریافت که در فشار و دمای ثابت یک مول از گازهای مختلف حجم ثابت و برابری دارند. این فرضیه بعدها به قانون آووگادرو معروف شد. حجم گازها تابعی از فشار و دمای آن هاست. به طور معمول حجم گازها را در دمای 0℃ (٢٧٣K) و فشار 1 اتمسفر (٧٦٠mmHg) بیان می کنند. این شرایط به شرایط استاندارد (STP) معروف است. حال با توجه به قانون آووگادرو یک مول از گازهای مختلف در شرایط استاندارد نیز که دما و فشار ثابت است، حجم ثابت و برابری خواهند داشت. این مقدار که به حجم مولی گازها در شرایط STP معروف است، برابر با ٢٢/٤لیتر می باشد.
شرایط استاندارد STP:
- دما: 0℃ یا K ٢٧٣
- فشار: 1 اتمسفر یا ٧٦٠mmHg یا ٧٦cmHg
- حجم یک مول گاز: ٢٢/٤L یا ٢٢٤٠٠ml
STP کوتاه شده عبارت Standard Temperature and Pressure است.
در حل بعضی از مسائل استوکیومتری مربوط به گازها می توان با استفاده از قانون نسبت های حجمی، ضریب تبدیل حجمی – حجمی مناسب را از روی معادله موازنه شده واکنش پیدا کرد و یا با استفاده از حجم مولی، ضرایب تبدیل مولی – حجمی مناسب را به دست آورد و از روی آن مقدار ماده مورد نظر را پیدا کرد.
مرکز یادگیری سایت تبیان - تهیه و تنظیم: مهسا شاه حسینی