
بررسی نتایج حاصل از PCR
اهداف:

آشنایی با بررسی نتایج حاصل از PCR

آشنایی با روش الکتروفورز

آشنایی با سفارش و تهیه پرایمر
شرح درس:
در پایان یک PCR ما محصول PCR را خواهیم داشت که در صورتی که ژن مورد نظر در محیط موجود بوده باشد، پرایمرهای اضافه شده به آن متصل شده و در نتیجه ما شاهد تعداد کپی های فراوانی از آن ژن هستیم. اما چگونه می توانیم مشاهده کنیم که در محصول PCR ما ژن مورد نظر موجود است؟
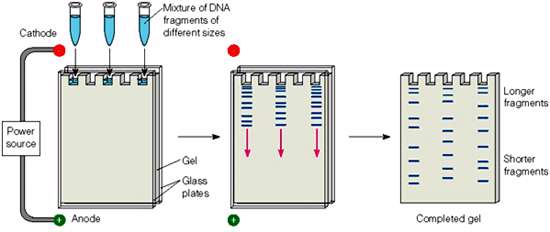
روش معمول بررسی محصولات PCR بردن نمونه ها روی یک ژل آگارز و الکتروفورز آن ها است. در هنگام الکتروفورز، قطعات تکثیر، شده که به واسطه گروه های فسفات دارای بار منفی هستند، در منافذ ژل آگاروز به سمت قطب مثبت حرکت می کنند و بر اساس وزن مولکولی از یکدیگر تفکیک می شوند. پس از اتمام الکتروفورز محصولات با رنگ های شیمیایی همچون اتیدیوم بروماید به شکل باند قابل رویت می گردند. رنگ های متیلن بلو یا کارولینا بلو هم می توانند جایگزین اتیدیوم بروماید شوند. اما به دلیل حساسیت و سرعت رنگ آمیزی، علی رغم جهش زا بودن، اتیدیوم بروماید ترجیح داده می شود. مقایسه اندازه باند ظاهر شده با یک استاندارد وزن مولکولی DNA-ladder میزان موفقیت واکنش را آشکار می سازد.
توضیح فیلم:
درصد ژل اگارز بسته با سایز باند ژن مربوطه متفاوت خواهد بود. به هر حال پس از ساختن درصد ژل مورد نظر از آن جایی که محصول PCR بدون رنگ است آن را با یک رنگ مخلوط کرده و در شانه های موجود در ژل اضافه می کنیم. این ژل در مایعی با PH خاص قرار دارد و از سمت قطب منفی به سمت قطب مثبت است و بنابراین می تواند محصول PCR روی آن حرکت کند.
اگر اندازه باند تکثیر شده دور از انتظار باشد، نشان از وجود محصولات غیر اختصاصی می دهد. این محصولات می توانند در نتیجه ورود آلودگی یا خطای جفت شدن ایجاد شوند. آلودگی ممکن است از سطح میزهای آزمایشگاهی و وسایل آزمایشگاه، سمپلرها، ذرات معلق در هوا از قبیل باکتری ها و یا حتی تکه ای بافت از قبیل پوست و مو، و یا استفاده از محلولهای آلوده وارد مخلوط واکنش PCR شود.
خطای جفت شدن زمانی رخ می دهد که پرایمر ها درحین جستجوی توالی مکمل خود روی رشته هدف، به نواحی متصل شوند که تنها مکمل بخشی از توالی آن ها باشند، و سپس این قطعه توسط آنزیم DNA پلیمراز ساخته شود. این محصول می تواند در چرخه های بعد هم به همین منوال تکثیر شود و باعث به وجود آمدن محصول غیر اختصاصی واکنش PCR شود. علاوه بر روش الکتروفورز، برحسب ضرورت می توان از روش هایی دیگر مانند ساترن بلات نیز استفاده نمود.
پرایمر های الیگونوکلئوتیدی
انتخاب پرایمر صحیح یکی از مهم ترین مراحل در طراحی آزمایش PCR است. در صورتی که توالی DNA الگو در دسترس باشد طراحی یک جفت پرایمر برای تکثیر هر ناحیه از DNA الگو، ساده بنظر می رسد.
بدین منظور می توان از برنامه های رایانه ای موجود در آدرس های اینترنتی http://primer3.sourceforge.net و http://perlprimer.sourceforge.net استفاده نمود.
شرکت های سازنده توالی طی چند روز پس از سفارش ساخت و خالص سازی پرایمر ها را انجام می دهند. اما برای طراحی مناسب یک جفت پرایمر رعایت نکات زیر ضروری است.
- طول هر پرایمر 18 تا 30 نوکلئوتید باشد.
- پرایمرها شامل تعداد تقریباً یکسان از هر 4 نوع نوکلئوتید باشند.
- از توالی های تکراری یا نواحی ردیفی شامل یک نوع نوکلئوتید اجتناب شود.
- از تکرار سه یا بیشتر C و G در انتهای 3 پریم خودداری شود. ممکن است منجر به اتصال اشتباه در نواحی غنی از GC شود.
- درصد CG توالی پرایمرها بین 35 تا 65 % انتخاب شود.البته در برخی منابع 45 تا 55 % پیشنهاد می شود.
- در صورت امکان شروع و خاتمه پرایمر با 1یا 2 باز پورینی باشد.
- امکان تشکیل ساختارهای ثانویه به دلیل مکمل بودن توالی های داخلی وجود نداشته باشد.
- انتهای 3 پریم پرایمر با خود یا با پرایمر دیگر امکان اتصال نداشته باشد در غیر اینصورت منجر به تشکیل پرایمر- دایمر می گردد.
در پایان از آزمایشگاه های موسسه تحقیقاتی رویان تشکر می کنم که همراهی مناسبی در تهیه این مقاله داشتند.
مرکز یادگیری سایت تبیان - تهیه: فاضل صحرانشین سامانی
تنظیم: مریم فروزان کیا

















