هدایت سنجی
دانش پژوهان گرامی در اینجا می خواهیم شما را با روشی بسیار پرکاربرد در آزمایشگاه های تصفیه آب و شیمی معدنی یعنی روش هدایت سنجی آشنا کنیم.
همان گونه که می دانیم هر جسمی که بتواند جریان الکتریسیته را از خود عبور دهد جسم هادی یا رسانا خوانده می شد. برای اینکه یک جسم مایع بتواند جریان الکتریسیته را از خود عبور دهد باید حاوی ذرات بارداری به نام یون باشد. یون ها می توانند مثبت یا منفی بوده و یک، دو و یا چند اتمی باشند. به عنوان مثال یون های فلوئورید (-F)، کلرید (-Cl) و یون کلسیم (+Ca٢)، یون های تک اتمی و یون های هیدروکسید(-OH)، نیترات (-NO3) و سولفات (SO42- ) یون های چند اتمی به شمار می آیند.
|
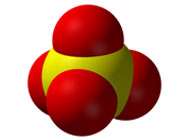
Nitrate Ion |
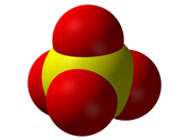
Sulfate Ion |
|
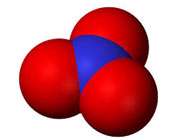
Hydroxide Ion
مانند اجسام رسانا محلول های یونی هم می توانند الکتریسیته را از خود عبور بدهند. وقتی دو الکترود را در محلول حاوی یون شناور کرده و اختلاف پتانسیل متناوبی را به آن اعمال کنیم، جریانی از محلول عبور کرده که متناسب با رسانایی محلول است و این رسانایی متناسب با تعداد یون های موجود در محلول بوده و بدین ترتیب تعداد یون های موجود در نمونه مورد نظر شناسایی می شود.
رسانایی به دست آمده تابع غلظت، تحرک و بار الکتریکی یون های موجود در محلول می باشد. به عنوان مثال هدایت یک یون تک بار مانند کبالت با دو بار مثبت (+Co2) یعنی کبالتی که دو الکترون خود را ازدست داده است، با کبالت سه بار مثبت (+Co3) متفاوت می باشد.
برای اندازه گیری هدایت محلول ها از دستگاهی به نام هدایت سنج یا کانداکتومتر (Conductometer) استفاده می شود.
برای اندازه گیری هدایت یک محلول، ابتدا در داخل یک بشر، حجمی از حلال مورد نظر را می ریزند و سپس الکترود را وارد محلول کرده و عدد مورد نظر که هدایت مربوط به حلال می باشد را بر حسب زیمنس یا میکرو زیمنس که واحد هدایت الکتریکی می باشد می خوانند.
رسانایی محلول تابع قانون اهم بوده و با عکس مقاومت محلول متناسب می باشد X=1/R.
همان طور که می دانیم یو نهای موجود در هر محلول سبب هدایت جریان الکتریسیته توسط آن محلول می شوند و چون یون های مختلف از نظر قابلیت هدایت جریان الکتریسیته با هم اختلاف دارند باید کمیتی برای جریان الکتریسیته در نظر گرفت تا بر مبنای آن بتوان قابلیت هدایت یون های مختلف را با هم مقایسه کرد و نسبت به هم سنجید.
کمیت انتخاب شده برای این منظور را به نام هدایت اکی والان می نامند. می توان آن را به صورت زیر تعریف نمود:
هدایت اکی والان یک یون، عبارت است از هدایت حجمی از محلول که شامل یک اکی والان گرم از آن یون، به شرط آنکه این حجم بین دو الکترود موازی که فاصله آنها از هم برابر یک سانتی متر و سطح هر یک از آنها از نظر عددی برابر حجم محلول بر حسب میلی لیتر باشد واقع شود. نمونه ای از یک الکترود استاندارد در شکل زیر نشان داده شده است.
باید دانست که در ایجاد رسانایی محلول ها، تمام ذرات باردار موجود در محلول شرکت نموده و جایگزینی یکی از آن ها با یک یون دیگر موجب تغییر رسانایی محلول می گردد. این امر اجازه می دهد پیشرفت واکنش هایی را که در جریان آن ها ترکیب یونی محیط دستخوش تغییر می شود با اندازه گیری مداوم رسانایی محیط دنبال نموده و با رسم منحنی تغییرات X=F به تشخیص نقطه ی پایان موفق شد.
چنین روشی را تعیین عیار هدایت سنجی می نامند که از آن در تشخیص نقطه ی پایان تیتراسیون های اسید - باز، اکسایش- احیا، ته نشینی، پیدایش کمپلکس و نیز واکنش های مبادله ی یون و استخراج بهره می گیرند.
مطالب مرتبط:
رابطه بین مول و مواد مرکب در شیمی
مرکز پژوهش های دانش آموزی تبیان، تهیه: نفیسه مدانلو
تنظیم: نسرین صادقی