سلول های الکترولیتی
چکیده:
علاوه بر سلول های گالوانی گروه دیگری از سلول های الکتروشیمیایی وجود دارند که به آن ها سلول الکترولیتی می گویند. در این مطلب به معرفی این سلول ها می پردازیم.
شرح درس:
در سلول های الکترولیتی انرژی الکتریکی به انرژی شیمیایی تبدیل می شود و با اعمال یک ولتاژ بیرونی، هر دو نیم واکنش الکترودی با صرف انرژی به سمت ایجاد تغییر شیمیایی دلخواه در جهتی خلاف جهت طبیعی، رانده می شوند. در نتیجه مواد به گونه هایی باردار شکسته می شوند که می توانند در میدان الکتریکی ایجاد شده در محلول، به سمت قطب ناهمنام خود جریان یابند.
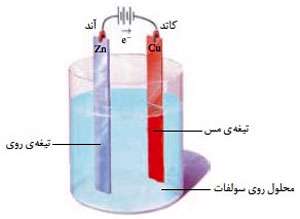
یک سلول الکترولیت شامل دو الکترود است که در یک محلول الکترولیت فرورفته است. محلول الکترولیت می تواند یک ترکیب یونی مذاب یا محلول یک ماده ی یونی در آب باشد.
در سلول الکترولیتی، الکترودی که به قطب مثبت باتری وصل می شود آند نامیده می شود که بعد از قرارگیری در محلول الکترولیت الکترون های حاصل از اکسایش گونه های موجود در الکترولیت را از آن خارج می کند. الکترودی که به قطب منفی باتری وصل می شود کاتد نامیده می شود که بعد از قرارگیری در محلول الکترولیت الکترون های مورد نیاز برای کاهش گونه های موجود در الکترولیت را از منبع به الکترولیت انتقال می دهد.
داخل محلول، یون های مثبت به سمت کاتد که قطب منفی است می روند که به آن ها کاتیون گفته می شود و یون های منفی به سمت آند که قطب مثبت است حرکت می کنند و آنیون نامیده می شوند.
کاتیون ها در سطح کاتد کاهش یافته و آنیون ها در سطح آند اکسایش می یابند. وقوع نیم واکنش کاهش و نیم واکنش اکسایش در الکترودها به غلظت محلول و موقعیت یون ها در جدول E° بستگی دارد.
سلول های الکترولیتی در تجزیه ی محلول ها و مواد مذاب، پالایش و آبکاری فلزها مورد استفاده قرار می گیرند.