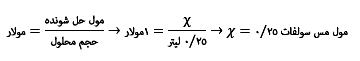کمیکار - جلسه سوم
اهداف:
آشنایی با محلول سازی
آشنایی با تعاریف با مولار و درصد حجمی
وسایل مورد نیاز: بالن ژوژه 100 سی سی، بالن ژوژه 250سی سی، بالن ژوژه500 سی سی، ترازو، قاشقک، هم زن شیشه ای، شیشه ساعتی، پتاسیم یدید، مس سولفات، سدیم کلرید (نمک طعام)، آب مقطر
تعاریف محلول سازی
محلول: یک ترکیب همگن را می توان محلول دانست. هر محلول از دو قسمت تشکیل شده است: حل شونده و حلال. بسته به میزان حل شونده نسبت به حلال در شرایط دمایی مختلف، حلال ها در 3 شرایط می توانند قرار داشته باشند:
1- سیر نشده
2- سیر شده
3- فوق سیر شده.
به عبارت دیگر هر حلال با توجه خصلت خود و ماده حل شونده و هم چنین شرایط دمایی، توانایی مختلفی در حل کردن حل شونده دارند، اگر کمتر از این حد، حل شونده اضافه گردد، محلول در حالت سیر نشده قرار دارد. اگر مقدار حل شونده در حد مرزی باشد، محلول سیر شده است و اگر این مقدار بیشتر گردد، محلول به صورت فوق سیر شده قرار می گیرد.
غلظت: در علم شیمی، غلظت را وفور یک ماده در کل ترکیب بیان می کنند. برای بیان شرایط غلظت، تعاریف متفاوتی وجود دارد. اما آنچه در کمیکار نیاز است، بیشتر دو تعریف درصد حجمی و مولاریته است.
در علم شیمی انواع و اقسام تعاریف برای غلظت وجود دارد که هر کدام از آنها برای کاربرد خاص تعریف شده و استفاده می گردند. از امثال آنها می توان به درصد جرمی، درصد حجمی، مولار، مولال، .... اشاره کرد.
درصد حجمی
درصد حجمی برای سیال ها تعریف می شود. به مایعات و گازها سیالات گویند اما از آنجا در مبحث کمیکار بیشتر با مایعات کار می کنیم، تعریف گازها در این زمینه جایی ندارد. طبق تعریف درصد حجمی به صورت زیر تعریف می شود:
حجمی درصد:
توجه داشته باشید که باید تمامی واحد های ماده حل شونده و محلول یکسان باشند. واحد های قابل استفاده برای مایعات عبارتند از: لیتر، سی سی، سانتی متر مکعب. هر 1000 سی سی، هر یک سی سی با یک سانتی متر مکعب برابر است.
مولاریته
طبق تعریف مولاریته را به صورت زیر انجام می دهند:
نکته: حجم محلول باید بر اساس لیتر باشد. در صورتی قرار دادن حجم بر اساس میلی لیتر، محاسبات اشتباه خواهد شد.
قبل از اینکه طریقه ساختن محلول با تعریف مولاریته بیان شود، بهتر است نحوه محاسبه مول ماده را بیان کرد:
مول
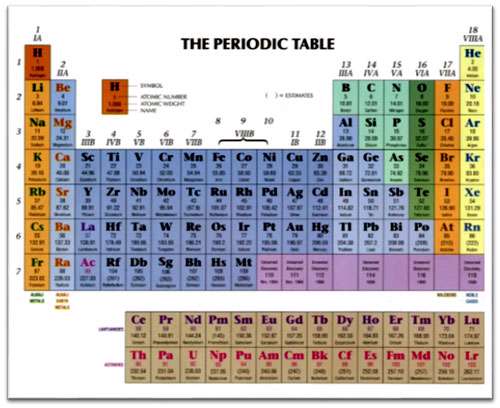
در هر خانه جدول تناوبی در کنار هر عنصر، عددی برای بیان عدد جرمی وجود دارد. برای مثال با توجه به جدول زیر برای اتم هیدروژن، عدد 1/008 و برای عنصر تیتانیم عدد 44/88 به عنوان عدد جرمی بیان شده است. عدد جرمی در اصل مجموع جرم دو ذره بنیادی یعنی پروتون و نوترون است.
این مقادیر برای یک مول از ماده محاسبه شده است. هر ترکیب شیمیایی از دو یا چند عنصر شیمیایی تشکیل گردیده لذا برای محاسبه جرم یک مول از هر ترکیب شیمیایی لازم است جرم هر عنصر که در ترکیب موجود است را با توجه به تعداد آن محاسبه کنیم و این مقادیر را با هم جمع نماییم. برای مثال در ترکیب آب با فرمول شیمیایی H2O از عنصر هیدروژن 2 عدد و از عنصر اکسیژن 1 عدد داریم. لذا یک مول مولکول آب دارای جرمی است که از طریق زیر محاسبه می شود:
H2O→H2 +O1
هر اتم هیدروژن 1/008 گرم و هر اتم اکسیژن 16 گرم است. پس هر مول مولکول آب برابر می شود:
H2O→2H +1O →2(1/008)+1(16)=18/016≈18 gr/mol
پس هر مول مولکول آب تقریبا 18گرم است. به عبارت دیگر اگر شما 18 گرم آب مقطر در اختیار داشته باشید، یک مول مولکول آب خواهید داشت.
یک مثال دیگر: یک مول سدیم کلرید چقدر وزن خواهد شد؟
سدیم کلرید دارای فرمول شیمیایی NaCl می باشد. هر 1 مول سدیم کلرید داری 1 مول سدیم و 1 مول کلر است. وزن هر مول سدیم برابر 22/99 گرم و هر مول کلر 35/45 گرم است. لذا هر مول سدیم کلرید از طریق زیر محاسبه می شود:
NaCl→ یک مول سدیم + یک مول کلر
پس در واقع یک مول سدیم کلرید 58/44 گرم خواهد شد.
چگونه محلول ملولاریته بسازیم؟
برای اینکه بتوانیم یک محلول مولاریته را راحت تر بسازیم، نیاز به گام بندی همراه با مثال داریم. برای این منظور می خواهیم محلول 1 مولار مس سولفات را بسازیم. گام به گام جلو می رویم:
گام اول: در گام اول حتما باید بدانیم محلول باید چند مولار باشد. در مثال ما محلول 1 مولار است.
گام دوم: حجم ظرفی که قرار است در آن محلول ساخته شود را انتخاب می کنیم. برای مثال، از بالن ژوژه 250 سی سی استفاده شده است.
گام سوم: در این گام باید، باید مقدار مول مورد نیاز را محاسبه کنیم. برای این منظور، باید ابتدا کسر را تشکیل دهیم. نکته اصلی آن است که باید مخرج کسر را بر حسب لیتر بنویسیم. اگر در مخرج برای مثال بجای 0/25 لیتر، 250 سی سی قرار دهیم، محاسبات غلط خواهد بود. با این توجهات به ادامه محاسبات می پردازیم:
گام چهارم: در این گام هدف محاسبه جرمی است که باید برای ساختن محلول استفاده شود. 0/25 مول مس سولفات نیاز داریم. همان طور که معلوم است، ترازویی برای اندازه گیری برای وزن مول وجود ندارد. پس باید این مقدار را به گرم تبدیل کنیم و با ترازو اندازه گیری کنیم.
برای این منظور اول باید وزن یک مول مس سولفات را محاسبه کرده باشیم. 1 مول مس دارای جرمی برابر با 63/55 گرم، 1 مول گوگرد دارای جرمی برابر با 32/07 گرم و جرم 1 مول اکسیژن دارای جرمی برابر با 16گرم است. هر مول مس سولفات که دارای فرمول شیمیایی CuSO4 است، دارای 1 مول مس، 1 مول گوگرد و 4 مول اکسیژن است، پس خواهیم داشت:
1 مول مس سولفات = 63/55×1 گرم برای مس+ 32/07×1 گرم برای گوگرد + 16×4 گرم برای اکسیژن=159/62 گرم
پس 1 مول مس سولفات وزنی در حدود 160 گرم دارد. ما نیاز به 0/25 مول مس سولفات داریم. نتیجه اینکه ما نیاز به 40 گرم مس سولفات خواهیم داشت.
گام پنجم: مقدار محاسبه شده را با ترازو محاسبه می کنیم و در داخل بالن ژوژه می ریزیم.
گام ششم: به مقدار مس سولفات وزن شده، آب مقطر اضافه می کنیم تا به خط بالن برسد.
نکته:
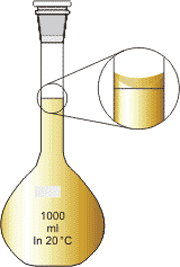
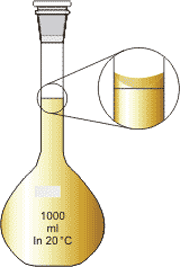
نحوه نگاه کردن به بالن ژوژه: برای این منظور باید چشم در راستای خط قرار بگیرد. سپس با توجه به شکل باید انحنای ناشی از مویینگی با خط بالن هم راستا باشد. تصویر 3-2، نمایانگر این موضوع است و بخوبی نشان می دهد که چگونه باید حجم را مطالعه کرد.
نحوه خواندن درست حجم محلول
گام هفتم: در بالن را گرفته و محکم تکان دهید تا محلول یک دست ایجاد شود. نکته مهم آن است که نباید از بالن محلولی خارج شود در غیر این صورت، حجم محلول از مقدار دقیق بالن خارج شده و مسلما محلول با غلظت بیشتر به دست می آید. نحوه صحیح هم زدن محلول به این گونه است که با کف ظرف عدد 8 را بنویسیم.
تکلیف1: عدد جرمی آلومینیوم سولفات (Al2SO4)، پتاسیم پرمنگنات (KMnO4)، سدیم هیدروکسید (NaOH) را محاسبه کنید.
تکلیف2: محاسبه کنید برای محلول 0/4 مولار آلومینیوم هیدروکسید (Al(OH)3 را برای بالن ژوژه 250 سی سی محاسبه کنید.
تکلیف3: چه ظروف آزمایشگاهی برای جابجایی محلول و تنظیم مناسب هستند؟
منبع مطالعه: شیمی عمومی 2، چالز مورتیمر، ترجمه عیسی یاوری، ویرایش ششم، انتشارات نشر علوم دانشگاهی، فصل 12
محل بازدید/اردو/خرید: برای این قسمت به آزمایشگاه مدرسه بروید و در آنجا به بررسی وسایل و موادی که برای محلول سازی به آن نیاز دارید بپردازید.
بخش پژوهش های دانش آموزی سایت تبیان
تهیه: هومن غریب زاده - تنظیم: یگانه داودی
مطالب مرتبط: