pH، کمیت لگاریتمی

pH یک کمیت لگاریتمی است که میزان اسیدی یا بازی بودن مواد را مشخص میکند. بررسی غلظت یون هیدروژن در اواخر سده نوزدهم برای برخی از صاحبان صنایع شیمیایی اهمیت ویژهای پیدا کرد. به عنوان مثال غلظت یون هیدروژن در طول فرایند تخمیر و فعالیت مخمرها اثر میگذارد و لازم بود که غلظت یون هیدروژن دائماً مورد بررسی قرار گیرد.
از طرفی چون غلظت یون هیدروژن معمولاً عددی بسیار کوچکی است و کار کردن با آن دشوار میباشد، نخستین بار سورِن سِن دانشمند دانمارکی در سال 1909 میلادی مقیاسی به نام pH را بنا کرد که بنا به تعریف pH برابر منفی لگاریتم مبنای 10 غلظت مولی یون هیدروژن فعال در محلول است.
در دمای اتاق PH آب خالص را 7 در نظر میگیریم زیرا در این دما غلظت یون هیدرونیم در آب خالص برابر7-10 است.
در دمای اتاق گستره بازه pH از (14 ~ 0) است که عدد صفر اسیدی ترین و عدد 14 بازیترین محیط را مشخص میکند و محلولی با PH = 7 را خنثی در نظر میگیریم.
با بالا بردن دما گستره بازه pH کمتر میشود؛ برای مثال در دمای 85 درجه این بازه به (13~0) تغییر میکند و محلولی با PH = 6/5 را خنثی فرض خواهیم کرد.
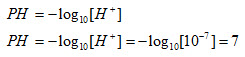
شناساگرها

شناساگرها در محیطهای اسیدی یا بازی به رنگهای متفاوتی درمیآیند. از شناساگرها برای تعیین pH محلولها استفاده میشود.
از جمله شناساگرهای معروف میتوان به این موارد اشاره کرد: گلبرگ گل سرخ، کاغذ تورنسل (لیتموس) که از درخت لیتموس به دست میآید.
محلول فنول فتالئین (که اگر در یک محلول بازی ریخته شود به سرعت رنگ محلول را ارغوانی میکند)، محلول متیل اورانژ (متیل نارنجی) و محلول متیلن بلو. استفاده از شناساگرهای شیمیایی وقت گیر و همراه با اشتباه در تعیین دقیق pH است؛ از این رو امروزه از pH سنج دیجیتالی استفاده میشود.
PH سنج دیجیتال
زمانی که دو فلز باهم تماس پیدا میآکنند با توجه به تفاوت تحرک الکترون در آنها اختلاف ولتاژ به وجود میآید. مشابه با این وقتی که یک فلز با یک مایع اسیدی یا نمکی تماس پیدا کند پتانسیل الکتریکی به وجود میآید که منتج به اختراع باطریها شد. به همین ترتیب در تماس دو مایع با یکدیگر نیز پتانسیل الکتریکی ایجاد میشود؛ اما برای جداسازی دو مایع از یکدیگر نیاز به یک غشاء میباشد.
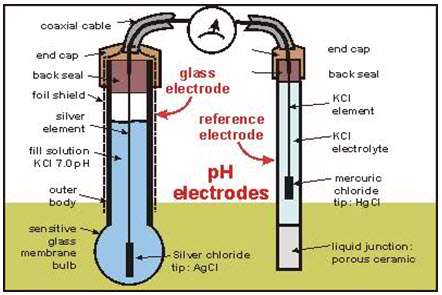
یک PH سنج در اصل پتانسیل الکتروشیمی بین یک مایع معلوم در داخل الکترود شیشهای و یک مایع مجهول در بیرون را اندازهگیری میآکند. به دلیل اینکه حباب شیشهای نازک بیشتر به یونهای کوچک و سریع الانتقال هیدروژن اجازه فعل و انفعال با شیشه را میدهد، الکترود شیشهای پتانسیل الکتروشیمی یونهای هیدروژن یا پتانسیل هیدروژن را اندازه می گیرد. برای تکمیل مدار الکتریکی به یک الکترود مرجع نیاز میباشد. توجه داشته باشید که دستگاه فقط ولتاژ الکتریکی را میسنجد نه جریان را، با این حال برای تشکیل یک پل هدایت به الکترود شیشهای نشتی جزئی یونها از الکترود مرجع لازم میباشد.
PH سنج نباید برای مایعات عبوری با رسانایی کم استفاده شود (بنابراین اندازهگیری در داخل محفظههای کوچک ترجیح داده میشود).
مرکز یادگیری سایت تبیان - تهیه: مرتضی عرفانیان
تنظیم: مریم فروزان کیا

















