آمین ها
در قسمت پنجم فصل اسیدها و بازها مختصری درباره ی آمونیاک و آمین ها صحبت شد و واکنش آنها با آب بررسی گردید، در اینجا بحث را پیرامون آمین ها با توضیح نحوه ی نام گذاری و مقایسه قدرت بازی آنها ادامه می دهیم.
تشکیل آمین ها:
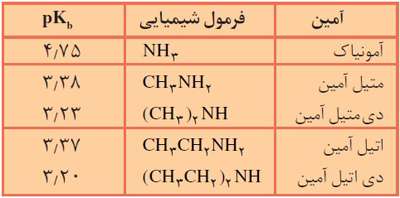
مولکول آمونیاک دارای سه اتم هیدروژن است (NH3) ، اگر به جای اتم های هیدروژن در آمونیاک گروه های آلکیل قرار بگیرد آمین تشکیل می شود. آمین ها سه نوع هستند و نوع آنها بستگی به تعداد گروه های آلکیل متصل به اتم نیتروژن دارد. اگر تنها یک گروه آلکیل به جای یک اتم هیدروژن در مولکلول آمونیاک قرار گیرد آمین نوع اول، اگر دو گروه آلکیل به جای دو اتم هیدروژن جایگزین شوند آمین نوع دوم و اگر هر سه اتم هیدروژن جای خود را به سه گروه آلکیل دهند آمین نوع سوم تشکیل می شود.
نام گذاری:
در روش معمول برای نام گذاری آمین ها ابتدا نام گروه های آلکیل متصل به نیتروژن و سپس واژه ی آمین آورده می شود. بدین ترتیب می توان مثال زد:
متیل آمین (آمین نوع اوّل): CH3NH2 ، اتیل آمین (آمین نوع اوّل): CH3CH2NH2
دی متیل آمین (آمین نوع دوم): (CH3)2NH ، تری متیل آمین (آمین نوع سوم): (CH3)3N
مقایسه قدرت بازی:
به طور کلی آمین ها بازهای ضعیفی هستند و در آب با پذیرفتن یک پروتون به صورت داتیو به یون آلکیل آمونیوم تبدیل می شوند. به معادله ی یونش متیل آمین و تفکیک آن به یون های متیل آمونیوم و هیدروکسید توجه کنید:
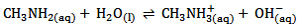
علت وجود خاصیت بازی در آمین ها این است که اتم N دارای جفت الکترون ناپیوندی است و می تواند H+ را به صورت داتیو جذب کند. همان طور که در مطلب مربوط به کربوکسیلیک اسیدها گفته شد گروه های آلکیل الکترون دهنده هستند. حال هر چه قدرت الکترون دهندگی گروه های آلکیل متصل به N بیش تر باشد، این اتم راحت تر می تواند جفت اکترون پیوندی خود را دراختیار H+ قرار دهد در نتیجه قدرت بازی بیش تر می شود. همین طور هر چه تعداد گروه های آلکیل متصل به N بیش تر باشد قدرت بازی هم بیشتر می شود. البته این به شرطی است که تعداد گروه های آلکیل در اطراف اتم نیتروژن با ایجاد ممانعت فضایی برای جذب H+ مشکل ساز نشوند. چون در برخی موارد مانند متیل آمین این اتفاق می افتد و قدرت بازی کاهش می یابد.
نکته: قدرت بازی اتیل آمین از متیل آمین بیش تر است چون قدرت الکترون دهندگی گروه اتیل (CH3CH2-) از قدرت الکترون دهندگی گروه متیل (CH3-) بیش تر است. هم چنین قدرت الکترون دهندگی دو گروه متیل از یک گروه اتیل بیش تر بوده که این سبب می شود قدرت بازی دی متیل آمین از اتیل آمین بیش تر باشد.