یون
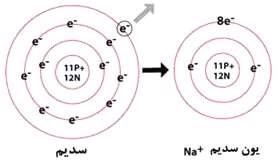
یون به اتمی گفته میشود که بار الکتریکی اضافه داشته باشد و این بار میتواند منفی یا مثبت باشد. یونها به دو نوع آنیون و کاتیون تقسیم میشوند. آنیون به یونی گفته میشود که به دلیل داشتن الکترونهای اضافی در لایه الکترونیاش دارای بار الکتریکی منفی باشد و کاتیون بر خلاف آنیون دارای بار الکتریکی مثبت است.
ماهیت یون
وقتی اتمها به یون تبدیل میشوند، خواص آنها شدیداً تغییر میکند. مثلاً مجموعهای از مولکولهای برم قرمز است؛ اما یون های در رنگ بلور ماده مرکب هیچ دخالتی ندارند. یک قطعه سدیم شامل اتم های سدیم نرم است. خواص فلزی دارد و بر آب به شدت اثر میکند؛ اما یون های در آب پایدارند.

مجموعه بزرگی از مولکولهای کلر، گازی سمّی به رنگ زرد مایل به سبز است، ولی یون های کلرید مواد مرکب رنگ ایجاد نمیکنند و سمّی نیستند. به همین لحاظ است که یون های سدیم و کلر را به صورت نمک طعام میتوان بدون ترس از واکنش شدید روی گوجه فرنگی ریخت. وقتی اتمها به صورت یون در میآیند، ماهیت آنها آشکارا تغییر میکند.
کاتیون
بیشتر کاتیونها، یون های تک اتمیاند که توسط فلزات به وجود میآیند. اگر فلز تنها یک نوع کاتیون ایجاد کند، نام یون، همانند فلز مربوط است.
+Na یون سدیم است؛ یعنی فلز سدیمی که ابتدا به صورت گازی در آمده است و از سدیم یک الکترون با اعمال انرژی یونش گرفته شده است. Mg+2 یون منیزیم است. برخی از فلزات بیش از یک نوع کاتیون به وجود میآورند. در اینگونه موارد، با نشان دادن تعداد بار کاتیون ها در نامشان آنها را متمایز میکنیم. بار این نوع کاتیون ها به صورت ارقام لاتین بعد از نام فارسی عنصر قرار داده میشود. +Cu، یون مس (I) و +Cu2 ، یون مس (II) است. در روشی قدیمیتر برای متمایز کردن دو نوع یون به وجود آمده از یک فلز، پسوندی به نام فلز افزوده میشود. در این روش، هرگاه نماد فلزی از لاتین مشتق شده باشد، از نام لاتین فلز استفاده میشود.
پسوند«و» برای یون دارای بار مثبت کمتر و پسوند« یک» برای یون با بار مثبت بیشتر مورد استفاده قرار میگیرد. +Cu ، یون کوپرو و +Cu2 یون کوپریک است. +Fe ، یون فرو و Fe+2 یون فریک است. توجه کنید که در روش بالا تعداد بارها به روشنی بیان نمیشود و نیز این روش برای فلزاتی که بیش از دو نوع کاتیون تولید میکنند، قابل استفاده نیست.
آنیون

آنیون های تک اتمی از اتم فلزات به وجود میآیند. نام آنها از طریق حذف بخش آخر نام عنصر و افزودن پسوند «ید» به باقیمانده به دست میآید. -Cl یون کلرید است. -O2، یون اکسید است و -N3 یون نیترید است؛ اما تمام آنیونهایی که نامشان به «ید» ختم میشود تک اتمی نیستند. بلکه معدودی آنیون های چند اتمی نیز نامشان با این پسوند ختم میشود؛ مثلاً -CN یون سیانید است و -OH یون هیدروکسید است. آنیونهای چند اتمی بسیاری شناخته شدهاند. به عنوان مثال -O22 یون پراکسید، Cr2O7-2 یون کرومات، -SO32 یون سولفیت است.
پیوند یونی
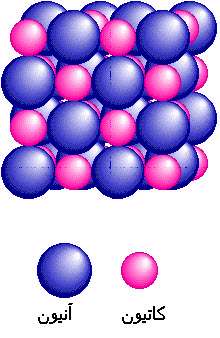
پیوند یونی نوعی از پیوند شیمیایی است که بر پایه نیروی الکترواستاتیک بین دو یون با بار مخالف شکل میگیرد. ترکیبات یونی متشکل از تعداد زیادی آنیون و کاتیون هستند که با طرح معین هندسی در کنار هم قرار گرفتهاند و یک بلور به وجود میآورند. هر بلور، به سبب جاذبههای منفی ـ مثبت یون ها به هم، نگهداشته شده است. فرمول شیمیایی یک ترکیب یونی نشانه سادهترین نسبت یونهای مختلف برای به وجود آوردن بلوری است که از نظر الکتریکی خنثی باشد.
خصوصیات پیوند یونی
الف- پیوند یونی میان دو اتم که اختلاف الکترونی آنها زیاد باشد (1/7 یا بیشتر) برقرار میشود.
ب- پیوند یونی میان فلزها و نا فلزها انجام میشود.
ج- در جریان این پیوند اتمهای فلزی (دارای یک تا سه الکترون در آخرین تراز خود و گاهی اوقات 4 الکترون) با از دست دادن الکترونهای آخرین تراز اصلی خود به یون مثبت (کاتیون) تبدیل میشوند و اغلب به آرایش گاز نجیب قبل از خود میرسند و باید دانست که بار کاتیون به تعداد الکترونهای از دسته میگویند.
د- اتمهای نافلزی (دارای چهار تا هفت الکترون در آخرین تراز اصلی خود) با گرفتن الکترون به یون منفی (آنیون) تبدیل میشوند و به آرایش گاز نجیب بعد از خود میدانست و بار آنیون مساوی تعداد الکترونهای از دست رفته میگویند.
س- نیروی ربایش میان یون مثبت و منفی در ترکیبهای یونی بسیار زیاد است به همین دلیل ترکیبهای یونی در دمای معمولی جامد هستند و به آن «جامد یونی» میگویند.
ص- در جامدهای یونی نیروی ربایش میان یون های ناهمنام در سه بعد از فضا گسترش مییابد به همین دلیل جامدهای یونی شکلهای هندسی منظمی دارند که به آنها «بلور یا شبکه بلور» میگویند.
ط- در شبکه بلور هر جامد یونی به سادهترین واحد تکراری یک بلور «سلول واحد» میگویند به بیان دیگر سلول واحد ساده ترین بخش یک بلور است که تصوری از ساختار سه بعدی همهی شبکه به دست میآید.
ع- در شبکه بلور جامدهای یونی و در سلول واحد آنها همواره تعدادی یون با بار همنام یک یون با بار مخالف را احاطه میکنند. باید دانست که ممکن است سلول واحد جامدهای یونی متفاوت از نظر تعداد یونهای که یون با بار مخالف را احاطه میکنند اختلاف داشته باشند. این تفاوت به تفاوت نسبی اندازه کاتیون و آنیون بلورهای مربوط است.
ق- در جامدهای یونی یون های مثبت و منفی به یکدیگر را میربایند به همین دلیل یونها فقط دارای حرکت ارتعاشی در مکانهای خود هستند به همین دلیل ترکیبهای یونی در حالت جامد رسانای الکتریسیته نیست ولی در حالت مذاب یا محلول که یون ها آزادی تحرک دارند جریان الکتریسیته را از خود عبور میدهند.
ل- چون نیروی ربایش میان یونهای غیرهمنام در جامدهای یونی بسیار قوی است این ترکیب ها دمای ذوب و جوش بالایی دارند.
مرکز یادگیری سایت تبیان - تهیه: مرتضی عرفانیان
تنظیم: مریم فروزان کیا

















