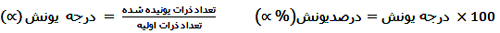درجه و درصد یونش
در این مطلب سعی بر آن است تا به دسته بندی اسیدها پرداخته و با مسائلی مربوط به یونش آشنا شویم تا در مطالب بعدی بهتر و بیش تر بتوانیم ثابت یونش اسیدی را معرفی کنیم.
فرآیند یونش:
برخی مواد به هنگام حل شدن در آب به میزانی تبدیل به یون می شوند که به آن فرایند یونش گفته می شود. این میزان برای مواد مختلف متفاوت است. برای اینکه بتوان میزان یونش مواد مختلف را با هم مقایسه کرد، معیاری به نام درجه ی یونش (∝) به کار گرفته می شود.
نکته: در این فرمول به جای واژه ی «ذره» می توان از مولکول، مول و یا غلظت مولار استفاده کرد.
دسته بندی اسیدها:
اسیدها را بر مبنای میزان یونش یا تفکیکی که به هنگام حل شدن در آب دارند دسته بندی می کنند. اسیدهای قوی اسیدهایی هستند که بر اثر حل شدن در آب تقریباً به طور کامل یونش می یابند. در حالی که اسیدهای ضعیف در آب به طور جزئی یونیده شده و همواره اندک یون های حاصل از یونش آنها با مولکول های یونیده شده، در تعادل هستند.
دامنه ی تغییرات درجه ی یونش:
دامنه ی تغییرات درجه ی یونش از صفر تا یک است بدین صورت که:
درجه ی یونش اسیدها و بازهای قوی برابر یک یا نزدیک به یک است.
درجه ی یونش اسیدها و بازهای ضعیف بین صفر تا یک و بیش تر نزدیک به صفر است.
درجه ی یونش مواد آلی که به صورت مولکولی در آب حل می شوند (مانند الکل ها، استون، شکر، گلیسیرین و ... ) برابر صفر است.
نکته ی مهم: در حل مسائل درصد یونش به جای تعداد مول های یونیده شده ی اسید می توان تعداد مول های تولید شده ی H+ و یا آنیون اسید را قرار داد.
مثال: در محلول 0.04 مولار هیدروفلوئوریک اسید در دمای معین، مجموع غلظت یون فلوئورید و یون هیدرونیم برابر
2×10-5 مولار است. اگر غلظت یون هیدرونیم و غلظت یون فلوئورید را یکسان فرض کنیم، درصد یونش این محلول کدام است؟
جواب:
سوال: درجه ی یونش کدام ماده بین صفر تا یک است؟
1- C12H22O11
2- HI
3- HNO2
4- C2H5OH