
آمفوترها
بعد از بررسی انواع مدل های ارایه شده برای اسیدها و بازها و تعاریف مختلفی که از آن ها شده است، در این جا با گروه خاصی از مواد به نام آمفوترها و خواص ویژه ی آن ها آشنا خواهیم شد.

آمفوتر چیست؟
آمفوتر از یک واژه ی یونانی به معنی «هر دو» گرفته شده و در علم شیمی به ماده ای که در برابر اسیدها به عنوان باز و در برابر بازها به عنوان اسید عمل می کند آمفوتر می گویند.
توجه: در واژه نامه ی آخر کتاب درسی پیش دانشگاهی، ماده ای که بتواند در برخی واکنش ها مانند اسید و در برخی دیگر شبیه باز رفتار کند «آمفی پروتیک» است و اگر آمفی پروتیک هیدروکسید باشد به آن «آمفوتر» می گویند. امّا این تفاوت در بسیاری موارد در کتاب رعایت نشده است. طبق کتاب درسی، H2O با این که هیدروکسید نیست یک آمفوتر محسوب می شود، ولی چون هم می تواند پروتون بدهد و هم پروتون بگیرد، طبق مدل لوری – برونستد به عنوان اسید و هم به عنوان باز عمل می کند .
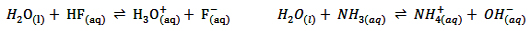
H2O در برابر NH3 به عنوان اسید و در برابر HF به عنوان باز و پذیرنده ی پروتون عمل می کند و این موضوع بیان گر وجود خاصیت آمفوتری در آب است.
چند آمفوتر:
- فلزهای سرب، آلومینیم، قلع، بریلیم و روی و هم چنین اکسید و هیدروکسید این فلزها آمفوتر هستند.
- اغلب یون های منفی دارای هیدروژن که حاصل یونش اسید هستند آمفوتر محسوب می شوند،
مانند H2PO3- , H2PO4- , HCO3- , HS- و ...
نکته: یون های H2PO2- و HPO32- آمفوتر نیستند.
- آمیونو اسیدها نیز آمفوتر هستند.
آلومینیم اکسید:
آلومینیم اکسید (AL2O3) در آب انحلال پذیر نیست و اگر پودر آن در آب ریخته شود یک مخلوط شیری رنگ کدر به دست خواهد آمد. این ماده طی یک فرایند شیمیایی هم در اسیدها و هم در بازها حل می شود و یک نمک محلول در آب به دست می آید. محلول به دست آمده شفاف و بی رنگ است.
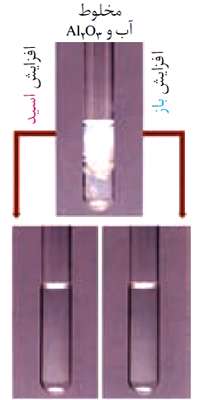
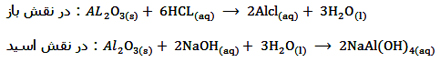
در مورد واکنش دوم فرض بر این است ابتدا AL2O3 با آب واکنش داده و تبدیل به Al(OH)3 می شود. اتم آلومینیم در
AL(OH)3 دارای اوربیتال خالی است و طبق مدل لوویس می تواند جفت الکترون ناپیوندی را از یک یون OH- ناشی از محلول سدیم هیدروکسید به صورت داتیو جذب کند و یون AL(OH)4- را تشکیل دهد.
سوال: کدام گونه خاصیت آمفوتری ندارد؟
1- H2O
2- HCO3-
3- ZnO
4- H3O+

















