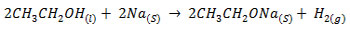واکنش اتانول با سدیم
واکنش اتانول با سدیم در یک «فکر کنید» در کتاب درسی مطرح شده است. امّا این واکنش آن قدر مهم و پر از نکته است که لازم دانستیم در یک مطلب جداگانه آن را موشکافی کنیم تا تمامی نکات نهفته در آن را استخراج کرده باشیم. با ما همراه باشید.
اتانول (CH3CH2OH) که یک ترکیب آلی اکسیژن دار است مطابق معادله ی شیمیایی زیر با فلز سدیم واکنش می دهد.
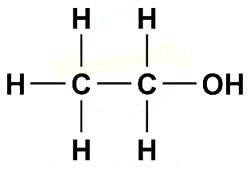
به ساختار اتانول (اتیل الکل) توجه فرمایید. در این ساختار 6 اتم هیدروژن وجود دارد امّا در واکنش با سدیم فقط هیدروژنی توسط سدیم جانشین می شود که متصل به اکسیژن است.
سوال: چرا سدیم نمی تواند جایگزین یکی از اتم های هیدروژنی متصل به کربن شود؟
جواب: اکسیژن الکترونگاتیوی زیادی دارد و می تواند جفت الکترون ناپیوندی اتم هیدروژن را بگیرد و آن را به صورت یون H+ آزاد کند. اما کربن الکترونگاتیوی نسبتاً کمی داشته و نمی تواند الکترون هیدروژن را از آن جدا کند و یونH+ آزاد سازد.
- در ساختار مواد آلی اکسیژن دار (مانند الکل ها) فقط هیدروژن متصل به اکسیژن خاصیت اسیدی دارد.
نکته: C2H6O دارای دو ایزومر به نام های اتانول (CH3CH2OH) و دی متیل اتر (CH3 –O - CH3) است. دی متیل اتر با وجود این که یک ترکیب آلی اکسیژن دار است ولی چون پیوند O – H ندارد بر سدیم بی اثر است.
البته هیدروژن متصل به کربن پیوند سه گانه نیز خاصیت اسیدی دارد امّا توجیه آن خارج از سطح پیش دانشگاهی است.
نکته: به طور کلی فقط هیدروژن متصل به عنصرهای گروه های 16 و 17 (مانند H2O , HF , HCL و ... ) خاصیت اسیدی دارد زیرا عنصرهای این دو گروه الکترونگاتیوی بالایی دارند و می توانند با کندن جفت الکترون پیوندی هیدروژن، آن را به صورت H+ اسیدی آزاد کنند.
سوال: نیتروژن نیز الکترونگاتیوی بالایی دارد امّا چرا H متصل به آن در ترکیب هایی مانند NH3 خاصیت اسیدی ندارد؟
جواب: اتم N با سه پیوند به سه اتم H متصل است و بار منفی زیادی دارد، در نتیجه تمایلی به جذب الکترون هیدروژن و آزاد کردنH+ ندارد، در ضمن اتم N به خاطر داشتن جفت الکترون ناپیوندی می تواند در نقش یک باز، پروتون (H+ ) جذب کند که در مطالب بعدی توضیحات بیش تری را پیرامون این موضوع خواهید خواند.
نکته: واکنش آب با سدیم شدیدتر و پرسرعت تر از واکنش اتانول با سدیم است. علت این است که در اتانول گروه آلکیل متصل به اکسیژن یعنی اتیل (C2H5) الکترون دهنده بوده و از لحاظ الکترونی تا حد زیادی اکسیژن را تأمین می کند. به همین خاطر این اتم اکسیژن تمایل زیادی برای کندن الکترون از هیدروژن متصل به خود ندارد. امّا اکسیژن در H2O انگیزه ی بالایی داشته و با تمایل بیش تری الکترون هیدروژن را جدا کرده وH+ اسیدی را راحت تر آزاد می کند.
توجه: در واکنش اتانول با سدیم، فاز اتانول باید مایع باشد. در صورت محلول بودن اتانول، مولکول های آب در محیط واکنش حضور داشته و به سرعت به فلز سدیم حمله می کنند و به اتانول اجازه ی شرکت کردن در واکنش را نخواهد داد.
نکته: نام C2H5ONa ، سدیم اتوکسید یا سدیم اتیلات است.