
آمونیاک سازی به روش هابر
به طور کلی تعادل های شیمیایی و مسائل مربوطه، اصول و عوامل دخیل و موثر در برقراری و جا به جایی تعادل ها مورد بحث قرار گرفتند. حال در اینجا به عنوان آخرین مطلب از فصل تعادل شیمیایی قصد داریم شما را با کاربرد یک نمونه از واکنش های تعادلی در صنعت، یعنی ساخت ماده پرارزش آمونیاک آشنا کنیم. با ما همراه باشید.
دست یابی به آمونیاک:
طی سال های متمادی، تعدادی از شیمی دان ها تلاش کردند تا آمونیاک را از هیدروژن و نیتروژن تهیه کنند تا اینکه سرانجام در سال 1904 میلادی یک دانشمند آلمانی به نام فریتس هابر موفق شد به همراه همکارش لروسینول دستگاهی بسازد که در فشارهای 150 تا 250 اتمسفر و دمای550℃ و در حضور کاتالیزگر اورانیوم می توانست در « مقیاس آزمایشگاهی» آمونیاک تولید کند. به همین دلیل به افتخار این دانشمند به فرایند ساخت آمونیاک طبق واکنش زیر «فرایند هابر» می گویند.
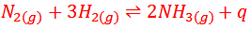
پس از آنکه عملی بودن این روش در آزمایشگاه ثابت شد، کارل بوش دیگر دانشمند آلمانی، موفق به انجام این فرایند در « مقیاس صنعتی» شد و نهایتا نخستین کارخانه آمونیاک سازی، با این روش در سال 1913 در آلمان شروع به کار کرد.
کاربردهای آمونیاک:
از این ماده پرارزش در تهیه کود شیمیایی، مواد منفجره و بسیاری از مواد شیمیایی صنعتی – تجاری استفاده می شود.
تهیه مواد اولیه مورد نیاز در روش هابر:
نیتروژن مورد نیاز از تقطیر هوای مایع و گاز هیدروژن از طریق عبور بخار آب داغ از روی زغال داغ (C) به دست می آید.
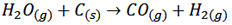
یک روش دیگر برای تهیه گاز هیدروژن، پالایش نفت خام است.
شرایط حاکم بر روش هابر:
فشار:
اگر واکنش تعادلی تولید آمونیاک را در نظر داشته باشید متوجه خواهید شد برای افزایش تولید آمونیاک می توان فشار را زیاد کرد. زیرا با افزایش فشار، تعادل به سمتی جا به جا می شود که مجموع ضرایب استوکیومتری مواد گازی آن کمتر است. بنابراین در فشارهای بالا واکنش در جهت تولید NH3(g) پیش می رود. به همین دلیل تا آنجا که ممکن باشد فرایند هابر در فشارهای بالا انجام می شود. در صنعت روش هابر را در فشاری بین 150 تا 350 اتمسفر انجام می دهند.
دما:
همان طور که مشاهده می کنید فرایند هابر گرماده است، پس قاعدتا با کاهش دما طبق اصل لوشاتلیه می توان تعادل را به سمت تولید آمونیاک بیشتر جا به جا کرد. اما این روش از دیدگاه صنعتی و اقتصادی به ضرر تولید آمونیاک است زیرا کاهش دما، سرعت واکنش های رفت و برگشت را نیز کاهش داده و سرعت برقراری تعادل بسیار پایین می آید. در صنعت هدف این است که در مدت زمان کمتری آمونیاک مورد نظر بدست بیاید. بنابراین روش هابر در مقیاس صنعتی در دماهای بالا ( حدود 550℃ ) انجام می شود.
کاتالیزگر:
در صنعت برای اینکه سرعت برقراری تعادل و در نتیجه سرعت تولید آمونیاک را باز هم بیشتر کنند واکنش مورد نظر را در مجاورت کاتالیزگر آهن (Fe) و اکسیدهای فلزی مانند MgO و Al2O3 انجام می دهند. در واقع کاتالیزگر کمک می کند تا در دماهای به نسبت پایین تر، آمونیاک سریع تر تشکیل شود و در نتیجه NH3(g) به مقدار بیشتر و ارزان تر تولید شود. اگر از کاتالیزگر استفاده نکنیم مجبوریم دما را تا حدود 1000℃ افزایش دهیم، دمای بالا باعث جا به جایی تعادل در مسیر برگشت و تجزیه مقداری از NH3 تولید شده می شود، هم چنین دمای بالا استهلاک دستگاه ها را زیاد کرده و عمر مفید آنها را کاهش می دهد. اما با استفاده از کاتالیزگر می توانیم در دمای پایین تر ( برای مثال حدود 450℃ ) به سرعت مطلوب برسیم.
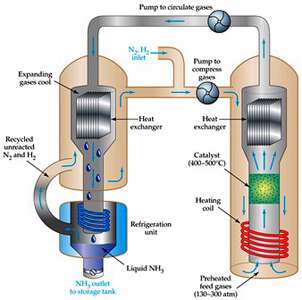
نکته مهم: یکی از جنبه های اصلی فرایند هابر، خارج کردن NH3(g) از محیط واکنش از طریق مایع کردن گاز آمونیاک است. با این کار تعادل به سمت کامل شدن پیش می رود. در ضمن N2(g) و H2(g) واکنش نکرده، بازگردانی می شوند.

















