
دو تعادل رنگارنگ، اثر کاتالیزگر
در ادامه بحث اثر دما بر روی جا به جایی تعادل دو مطلب راجع به دو واکنش بسیار مهم در کتاب درسی بر جای مانده بود که در این مقاله به طور مفصل به آنها پرداخته شده است. دقت داشته باشید به خاطر سپردن این دو واکنش مهم و رنگ مواد در آنها خالی از لطف نخواهد بود. هم چنین در انتها اثر کاتالیزگر را نیز بر روی تعادل بررسی می کنیم.
به تعادل زیر توجه فرمایید:
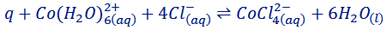
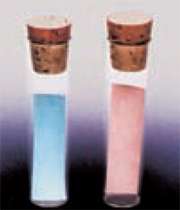
همان طور که مشاهده می کنید این تعادل در جهت رفت گرماگیر است. رنگ مواد در این تعادل بسیار ضروری است. باید بدانید Co(H2O)62+ صورتی رنگ و CoCl42- آبی رنگ است.
حال اگر یک لوله آزمایش حاوی تعادل فوق را در آب جوش قرار دهیم با افزایش دما، طبق اصل لوشاتلیه این تعادل در جهت رفت جا به جا می شود و غلظت CoCl42- که آبی رنگ است افزایش یافته و محلول به رنگ آبی در می آید. اما اگر لوله آزمایش را در مخلوط آب و یخ قرار دهیم دما کاهش می یابد و تعادل در جهت برگشت و افزایش غلظت Co(H2O)62+ پیش می رود و محلول به رنگ صورتی دیده می شود.

یادآوری: تغییر فشار بر این تعادل بی اثر است چون در آن ماده گازی شکل نداریم.
نکته: با اضافه نمودن مقداری NaCl به ظرف واکنش غلظت Cl- زیاد شده و طبق اصل لوشاتلیه تعادل در جهت رفت جا به جا می شود و رنگ مخلوط تعادلی به آبی می گراید.
حال به این تعادل توجه فرمایید:
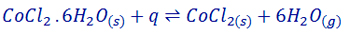
کبالت (∥) کلرید 6 آبه (CoCl2 . 6H2O) یک نمک آبپوشیده به رنگ صورتی است که با گرم شدن، مولکول های آب خود را از دست می دهد و CoCl2(s) که آبی رنگ است بر جای می ماند. توجه داشته باشید فرایند آب گیری از نمک های آبپوشیده یک فرایند برگشت پذیر بوده و می تواند به تعادل برسد. اگر کبالت(∥) کلرید بدون آب در هوای مرطوب قرار گیرد مجددا با جذب 6 مولکول آب تبدیل به CoCl2 . 6H2O می شود.
برای اثبات این امر دو کاغذ صافی آغشته به محلول کبالت (∥) کلرید 6 آبه را خشک می کنیم تا آبی رنگ شوند، سپس یکی از کاغذها را در لوله آزمایش خشک و دیگری را در لوله آزمایش مرطوب قرار می دهیم. بعد از مدتی مشاهده می شود کاغذی که در لوله مرطوب بوده به رنگ صورتی در آمده است. این نشان می دهد رطوبت باعث شده CoCl2 با جذب 6 مولکول آب تبدیل به CoCl2 . 6H2O شود و صورتی رنگ گردد.
نام گذاری:
در یون Co(H2O)62+ ، یون Co2+ با 6 مولکول آب به صورت داتیو پیوند برقرار می کند و شکل یون حاصل به صورت هشت وجهی است.
- وقتی یک فلز جفت الکترون ناپیوندی را به صورت داتیو بپذیرد ماده حاصل را کمپلکس می نامند.
در نتیجه یون Co(H2O)62+ یک یون کمپلکس است. در نام گذاری کمپلکس ها، H2O را تحت عنوان آکوا نام گذاری می کنند پس نام یون Co(H2O)62+ یون هگزا آکوا کبالت (∥) است. CoCl42- نیز کمپلکس محسوب می شود چون در آن یک یون Co2+ با چهار یونCl- پیوند داتیو برقرار کرده است و شکل آن به صورت چهار وجهی بوده و به نام تترا کلرو کبالت (∥) خوانده می شود.
اثر کاتالیزگر:
کاتالیزگرها هیچ اثری بر جا به جایی تعادل ندارند. آنها تنها می توانند با کاهش انرژی فعال سازی رفت و برگشت به یک اندازه، سرعت واکنش رفت و برگشت را به یک اندازه افزایش دهند. به عبارتی دیگر کاتالیزگر زمان برقراری تعادل را کاهش می دهد.
تذکر: افزودن کاتالیزگر ثابت سرعت واکنش رفت و برگشت را به یک نسبت افزایش می دهد تا ثابت تعادل تغییری نکند.

















