
تفسیر ثابت تعادل
در این مقاله ما به تفسیر مقدار عددی ثابت تعادل خواهیم پرداخت و جزییات میزان پیشرفت واکنش ها بعد از رسیدن به تعادل را بررسی می کنیم.
انواع واکنش ها از نظر مقدار عددی K :
با توجه به مقدار عددی K در دمای ثابت می توان واکنش ها را به پنج دسته تقسیم کرد:
1- اگر مقدار عددی K حدود یک باشد؛ در این صورت در سامانه تعادلی مقدار واکنش دهنده ها و فراورده ها تقریبا یکسان است و گفته می شود تعادل در حالت میانه قرار دارد.
2- اگر مقدار عددی K بزرگتر از یک باشد؛ در این صورت در حالت تعادل حاصلضرب غلظت فراورده ها از حاصلضرب غلظت واکنش دهنده بیشتر بوده و تعادل در سمت راست قرار دارد.
3- اگر مقدار عددی K کوچکتر از یک باشد؛ در این صورت در حالت تعادل حاصلضرب غلظت فراورده ها از حاصلضرب غلظت واکنش دهنده ها کمتر بوده و تعادل در سمت چپ قرار دارد.
4- اگر مقدار عددی K بسیار بزرگ ( بزرگتر از حدود 1010 ) باشد؛ در این صورت واکنش دهنده ها تقریبا به طور کامل به فراورده ها تبدیل شده اند و مقدار بسیار ناچیزی از آنها باقی مانده است. در این حالت گفته می شود واکنش تقریبا کامل است یا در مرز کامل شدن قرار دارد.
5- اگر مقدار عددی K بسیار کوچک ( کوچکتر از حدود 10-10 ) باشد؛ در این صورت در دمای مورد نظر واکنش رفت تقریبا انجام نمی شود و غلظت فراورده ها بسیار ناچیز است.
با توجه به متن کتاب درسی، معروف ترین واکنشی که مقدار K برای آن بسیار کوچک است، واکنش تجزیه سنگ آهک(CaCO3) در دمای 25℃ می باشد.
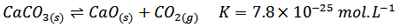
این واکنش به تعادل می رسد و مقدار K برای آن بسیار کوچک است و غلظت فراورده ها آنقدر ناچیز است که می توانیم بگوییم در دمای 25℃ واکنش رفت انجام می شود و سنگ آهک در دمای معمولی تجزیه نمی گردد.
نکته: سنگ آهک CaCO3 ناخالص و سنگ مرمر CaCO3 تقریبا خالص است در نتیجه مجسمه های مرمرین که از CaCO3 تقریبا خالص ساخته شده اند با گذشت زمان طولانی تغییرات محسوسی نمی کنند. این خود نشان می دهد سرعت تجزیه CaCO3(s) در دمای25℃ بسیار ناچیز است.


نکته مهم: در کتاب درسی شیمی 3 با فرض کامل بودن واکنش ها، محاسبه های استوکیومتری برای تعیین میزان تولید فراورده به کمک میزان مصرف واکنش دهنده، استفاده می شد. اما از اینجا به بعد باید بدانید تنها در صورتیکه مقدار عددی K بسیار بزرگ باشد ( یعنی واکنش در مرز کامل شدن قرار داشته باشد) می توان با بهره گیری از اصول استوکیومتری محاسبه های کمی را برای واکنش مورد نظر انجام داد. اما اگر مقدار عددی K بزرگ نبود محاسباتی از نوع مسائل K باید انجام دهیم.
اثر ترمودینامیک و سینتیک بر پیشرفت واکنش:
واکنش زیر را در نظر بگیرید:
در دمای 25℃
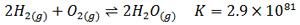
همانطور که می بینید مقدار K برای این واکنش بسیار بزرگ است، این امر نشان می دهد واکنش مورد نظر از نظر ترمودینامیکی مساعد بوده و با توجه به عوامل ترمودینامیکی ( مانند آنتالپی، آنتروپی و دما) سیستم بیشتر تمایل به تولید فراورده ها دارد. اما دلیل نمی شود که بگوییم الزاما سرعت واکنش نیز زیاد است. زیرا همانطور که می دانید سرعت واکنش در قلمرو علم سینتیک است نه ترمودینامیک. اینکه چه موقع تعادل برقرار می شود بستگی به سرعت واکنش دارد.
هنگامی که گارهای H2 و O2 را در دمای 25℃ وارد ظرف واکنش می کنیم دو حالت ممکن است پیش آید:
1- اگر هیچ دخالتی نکنیم ( یعنی از جرقه، گرما یا کاتالیزگر استفاده نکنیم)، این گازها بر هم بی اثر بوده و H2O(g) تولید نمی شود. علت این است که انرژی فعال سازی واکنش زیاد بوده و سرعت واکنش آنقدر آهسته خواهد بود که هرگز در دمای 25℃ به تعادل نمی رسد.
در این حالت شیمی دان ها می گویند که واکنش مورد نظر از نظر ترمودینامیکی مساعد است ( یعنی اینکه مقدار عددی K برای آن بزرگ است) اما به طور سینتیکی کنترل می شود ( یعنی اینکه سرعت بسیار کم مانع از انجام شدن آن می شود.)
2- اگر انرژی فعال سازی واکنش را به کمک دادن گرما یا جرقه یا کاتالیزگر تامین کنیم، واکنش به شکل انفجاری انجام می شود و به سرعت به تعادل رسیده و پس از آن تا مرز کامل شدن پیش می رود.

















