ایزوتوپ ها
.gif)
در سال 1239 شمسی (1910 م) دانشمندان با مشكلی مواجه شدند و آن این كه بعضی محصولات واپایشی ها. خواص شیمیایی یكسانی داشتند ولی خواص فیزیكی آن ها متفاوت بود. "سدی" كه یك دانشمند (شیمی دان) انگلیسی است متوجه شد محصول نهایی و پایدار واپاشی اورانیوم یا رادیم خواص شیمیایی سرب را دارد.
همچنین محصول نهایی واپاشی توریوم نیز خواص شیمیایی سرب را دارد ولی همه آن ها جرم اتمی متفاوت با سرب معمولی (طبیعی) داشتند.به عنوان مثالی دیگر، هسته هایی با عدد اتمی 6 كه مربوط به كربن هستند یافت میشدند كه عدد جرمی آن ها 12 نبود بلكه 13 و 14 بود.
حال این سۆال پیش آمد كه آیا در جدول تناوبی باید جای جدایی بر آن ها در نظر گرفت؟
دانشمندان به این نتیجه رسیدند كه هر خانه جدول متناوبی میتواند معرف عنصری باشد كه از نظر شیمیایی با عنصر دیگر تفاوت دارد. به همین خاطر عناصری كه خواص شیمیایی یكسانی داشتند (عدد اتمی یكسان) ولی از نظر فیزیكی خواص متفاوت نشان میدادند (عدد جرمی متفاوت داشتند) را ایزوتوپ نامیدند.
ایزوتوپ از دو كلمه isos به معنی هم و دیگری topos به معنی جا اقتباس شده است و تداعی كننده اینست كه این عناصر در یك خانه جدول تناوبی جای میگیرند.
بنابراین ایزوتوپهای یك عنصر دارای یك عدد اتمی هستند ولی عدد جرمی آن ها متفاوت است. یعنی تعداد نوترونهای هسته متفاوت میباشد. به عنوان مثال ایزوتوپهای كربن عبارتند از:
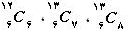
البته حدود 90 % كربن موجود در طبیعت به مقدار زیر است:
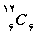
ایزوتوپهای سرب به مقدار زیر می باشد.
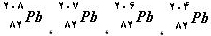
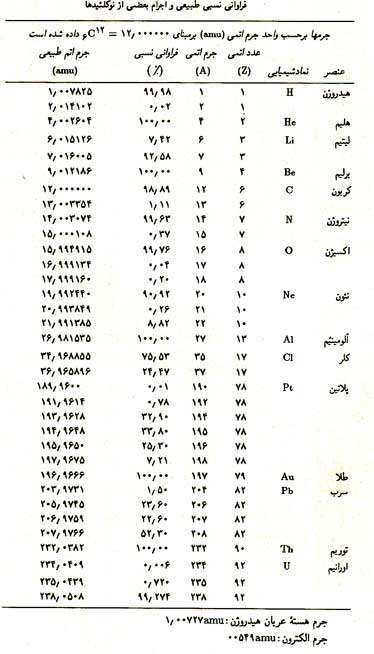
در جدول زیر ایزوتوپهای چند عنصر و درصد فراوانی آن ها را در طبیعت میبینید:
باید توجه داشت كه در فرآیندهای هستهای عدد اتمی و عدد جرمی دو طرف معادله یكسان است.
مرکز یادگیری سایت تبیان - تهیه: محسنی
تنظیم: مریم فروزان کیا

















