
برگشت پذیری و تعادل

در برخی از واکنش های شیمیایی، به نظر می رسد هیچ محصولی تشکیل نمی شود تا واکنش مورد نظر تمام شود. این حالت زمانی اتفاق می افتد که واکنش دهنده ها و محصولات همچنان در هر دو سمت واکنش در حال برهمکنش هستند (واکنش در هر دو جهت همچنان جریان دارد). این نوع واکنش ها را می توان به صورت زیر نشان داد:
A+B <---> C+D
یک مثال واقعی برای این واکنش شیمیایی، واکنش بین هیدروژن و ید است:
H2 + I2 <---> 2HI
واکنش های برگشت پذیر، واکنش های شیمیایی هستند که می توانند در هر دو جهت رفت و برگشت انجام شوند. جهت واکنش به شرایط واکنش دهنده ها بستگی دارد. زمانی که واکنش های برگشت پذیر به تعادل می رسند، غلظت واکنش دهنده ها و محصولات تغییری نمی کند.
نقطه تعادل واکنش می تواند توسط دما و همچنین فشار وارد بر گازها در تعادل عوض شود.
تعادل شیمیایی چیست؟
اگر تعادل شیمیایی در ظرفی اتفاق می افتد که یک یا بیش تر واکنش دهنده ها یا محصولات می توانند از آن ظرف فرار کنند، پس ما با یک سیستم باز روبرو هستیم. اگر واکنش شیمیایی در ظرفی اتفاق بیفتد که هیچ یک از واکنش دهنده ها و محصولات نتوانند فرار کنند، پس با یک سیستم بسته روبرو هستیم.واکنش های برگشت پذیری که در یک سیستم بسته اتفاق می افتند، بالاخره در یک زمان مشخص به تعادل می رسند.
تعادل شیمیایی:
گفتیم که در یک تعادل شیمیایی، غلظت واکنش دهنده ها و محصولات تغییری نمی کند. اما واکنش های رفت و برگشت متوقف نمی شوند و هر دو با آهنگ یکسان اتفاق می افتند.
تصور کنید روی یک پله برقی به طور برعکس راه می روید و سرعت راه رفتن شما با سرعت حرکت پله برقی یکسان است اما جهت های شما با هم متفاوتند. پاهای شما همچنان به سمت جلو حرکت می کنند و پله برقی به سمت عقب حرکت می کند. با این حال، نتیجه این است که شما دقیقا در همان جای خود می ایستید. این همان چیزی است که در یک تعادل اتفاق می افتد.
عوامل دیگر:
اگر محصولات را از یک ترکیب در حال تعادل خارج کنیم، واکنش دهنده های بیش تری به محصولات تبدیل می شوند. اگر یک کاتالیست در این واکنش استفاده شود (کاتالیست، آهنگ واکنش شیمیایی را تغییر می دهد؛ بدون این که خودش در واکنش تغییر کند)، واکنش زودتر به حالت تعادل می رسد؛ زیرا کاتالیست، سرعت واکنش های رفت و برگشت را به اندازه یکسان افزایش می دهد. غلظت واکنش دهنده ها و محصولات در این حالت، همان غلظتی است که بدون کاتالیست بوده است.
حال به فلش زیر دقت کنید:
|
|
در این فلش، واکنش دهنده ها و محصولات در حال تعادل هستند. روی کلمه movie کلیک کنید. اگر مقداری از محصولات برداریم، تعادل به هم می خورد. حال روی کلمه next کلیک کنید. برای این که دوباره تعادل حاصل شود، واکنش دهنده های بیش تری باید تغییر کرده و خود را به محصول تبدیل کنند.
تأثیر دما روی تعادل:
حال باید بدانیم اگر دما تغییر کند، چه اتفاقی برای مقدار محصول در یک ترکیب تعادلی می افتد:
- اگر واکنش رفت، گرماده باشد و دما زیاد شود، مقدار محصول کاهش پیدا می کند. اگر دما کاهش پیدا کند، مقدار محصول افزایش پیدا می کند.
- اگر واکنش رفت، گرماگیر باشد و دما افزایش پیدا کند، مقدار محصول افزایش یافته و اگر دما کاهش یابد، مقدار محصول کاهش پیدا می کند.
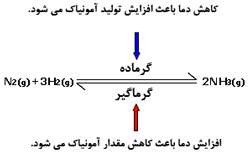
این موضوع برای فرایندهای صنعتی مانند فرایند هابر بسیار مهم است. واکنش رفت که برای کود دهی، آمونیاک تولید می کند، گرماده است. پس بازدهی برای آمونیاک در دمای کم تر، بهتر است.
ممکن است به نظر شما، مهندسان شیمی، دمای پایین را برای فرایند هابر انتخاب کنند؛ اما نکته مهم آن است که دمای بالا باعث سریع تر شدن واکنش می شود. بنابراین دما باید به اندازه ای بالا باشد که آهنگ واکنش در حد معقولی باشد؛ اما نه آن قدر بالا که محصول آمونیاک کم شود.

















