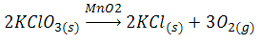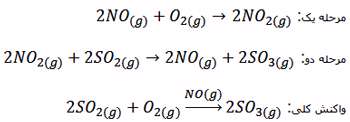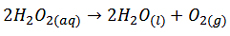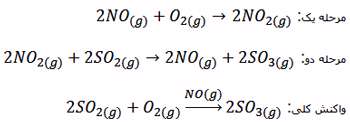اثر کاتالیزگر روی سرعت واکنش و انواع واکنش های کاتالیز شده
در درس دوم پنج عامل موثر بر سرعت واکنش های شیمیایی را معرفی کردیم و چهار عامل را توضیح دادیم، عامل پنجم کاتالیزگر است که در اینجا به تعریف و نحوه اثرگذاری آن روی سرعت واکنش خواهیم پرداخت. هم چنین در این درس شما می توانید با انواع واکنش های کاتالیز شده آشنا شوید.
کاتالیزگر:
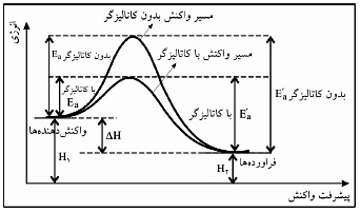
کاتالیزگر ماده ایست که در واکنش شرکت می کند و سرعت واکنش های شیمیایی را افزایش می دهد ولی در واکنش مصرف نمی شود. کاتالیزگر ساز و کار و مسیر انجام واکنش را تغییر می دهد و با کاهش دادن انرژی فعال سازی رفت و برگشت به یک میزان (توجه: نه به یک نسبت) باعث کاهش آنتالپی پیچیده فعال و افزایش سرعت واکنش می شود. در واقع در واکنش کاتالیز شده نسبت به واکنش کاتالیز نشده، ساختار پیچیده فعال متفاوت است به گونه ای که محتوای انرژی آن کمتر می باشد. هم چنین کاتالیزگر می تواند تعداد مراحل انجام یک واکنش را تغییر دهد.
نکته: کاتالیزگر روی ∆H واکنش رفت و ∆H واکنش برگشت تاثیر ندارد چون ∆H یک پارامتر ترمودینامیکی بوده در حالی که اثر کاتالیزگر یک اثر سینتیکی است، روی مسیر اثر دارد و روی پایگاه اول و آخر واکنش بی اثر است.
نکته: اگر واکنشی خود به خودی نباشد، با حضور کاتالیزگر هم خود به خودی نخواهد بود. زیرا خود به خودی بودن یا نبودن به عوامل ترمودینامیک ( ∆S و ∆H ) بستگی دارد که کاتالیزگر بر آن ها بی اثر است.
انواع واکنش های کاتالیز شده:
1- واکنش هایی که در آن ها کاتالیزگر و همه مواد واکنش دهنده در یک فاز باشند، کاتالیز شده همگن هستند.
2- واکنش هایی که در آن ها کاتالیزگر و مواد واکنش دهنده در یک فاز قرار نداشته باشند، کاتالیزشده ناهمگن هستند.
نکته: اگر کاتالیزگر به صورت یون باشد، فاز آن را محلول (aq ) در نظر می گیریم. اگر به صورت یک فلز خنثی یا به صورت اکسید فلزی ( مانند V2O5 یا MnO2 ) باشد، فاز آن را جامد (S ) در نظر می گیریم. زیرا اکسید فلز یک ترکیب یونی است و شبکه به هم فشرده ای از آنیون و کاتیون دارد.
توجه: واکنش زیر را در نظر بگیرید:
در این واکنش MnO2 کاتالیزگر بوده و یک اکسید فلزی است در نتیجه جامد است. درست است که MnO2 و KClO3 هر دو جامدند و از نظر حالت فیزیکی یکسان هستند. اما دو فاز جداگانه محسوب می شوند چون بنابر تعریف فاز خواص فیزیکی و شیمیایی آن ها متفاوت است در نتیجه این واکنش، از نوع کاتالیز شده ناهمگن می باشد.
نکته: اگر کاتالیزگر در فاز جامد باشد یا حداقل یکی از واکنش دهنده ها جامد بود، آن واکنش کاتالیز شده ناهمگن است.
دو واکنش مهم:
واکنش تولید گاز SO3 :
در این واکنش هدف تولید گاز SO3 بوده و لازم است بدانید مولکول NO2 نقش ذره حد واسط و NO نقش کاتالیزگر را دارد و در حضور این کاتالیزگر واکنش دو مرحله ای شده و دو پیچیده فعال تشکیل می شود.
واکنش تجزیه هیدروژن پراکسید (آب اکسیژنه) :
محلول هیدروژن پراکسید در دمای اتاق با سرعت بسیار کمی تجزیه می شود. اما اگر به آن اندکی FeSO4 که به صورت جامد است اضافه کنیم، بلافاصله به صورت FeSO4(aq) در آمده و یون های Fe(aq)2+ و SO4(aq)2- تولید می کند که
Fe(aq)2+ به عنوان کاتالیزگر وارد عمل شده و سرعت واکنش را بالا می برد. این واکنش کاتالیزشده همگن است. سرعت تجزیه محلول آب اکسیژنه را می توان با جمع آوری گاز اکسیژن آزاد شده در مدت زمان معین بررسی کرد.
برتری کاتالیزگر نسبت به دما:
در بسیاری از واکنش های صنعتی لازم است که سرعت واکنش طوری افزایش یابد که تولید فراورده ها از نظر اقتصادی مقرون به صرفه باشد. توجه کنید که بحث کارآیی اقتصادی یک فرایند، یک بحث صنعتی است نه آزمایشگاهی.
سوالی که مطرح می شود این است که چرا به جای افزایش دما جهت افزایش سرعت واکنش از کاتالیزگر استفاده می شود؟ در جواب باید گفت کاتالیزگر نسبت به دما دو برتری دارد:
- انرژی کمتری مصرف می شود و هزینه ها کاهش می یابد.
- خطر تجزیه گرمایی موادی که نسبت به گرما حساسند حذف می شود.