واکنش های اکسایش
در قدیم اصطلاح اکسیداسیون (اکسایش) برای واکنش هایی به کار برده میشد، که در آنها جسمی با اکسیژن ترکیب میگردید.
به همین ترتیب، اصطلاح احیا (کاهش) به واکنش هایی اطلاق میگردید که در آن ها اکسیژن از جسمی جدا میشود. امروزه، اصطلاح اکسایش-کاهش در معنای بسیار وسیعتری به کار میرود، به طوری که، کلیه واکنش هایی که در آن ها، الکترون از یک واکنش دهنده به واکنش دهنده دیگر منتقل میشود، واکنش های اکسایش-کاهش نامیده میشوند.
می دانید که اکسیژن نافلزی بسیار فعال است و با بسیاری از عنصرها ترکیب میشود. به همین علت بسیاری از عنصرهای موجود در طبیعت به صورت اکسید وجود دارند . مثلاً هیدروژن به صورت H2O و آهن به صورت Fe2O3 و آلومینیوم به صورت Al2O3 در طبیعت وجود دارند. در گذشته ترکیب شدن عنصرها با اکسیژن را اکسید شدن یا اکسیداسیون و اکسیژن را عنصر اکسید کننده مینامیدند. امروزه به جای اکسیداسیون اصطلاح اکسایش را به کار میبرند.
مثال:

اکسید شدن مس :
2Cu+O2 --->2CuO

اکسید شدن روی:
2Zn+O2 ---> 2 Zno
از زمانهای گذشته مهمترین راه به دست آوردن فلزات، گرفتن اکسیژن از اکسید آنها به وسیلهی ذغال (کربن) بوده است. این عمل را احیا شدن (زنده شدن) فلز و کربن را عنصر احیا کننده مینامیدند. امروزه به جای احیا شدن اصطلاح کاهش و به جای احیا کننده واژهی کاهنده را به کار میبرد.
هیدروژن نیز یک عامل کاهنده است مثلاً اکسید مسII را در گرما میکاهد.
مایکل فارادی فیزیکدان و شیمیدان انگلیسی که کشف بنزن و تهیهی کلر مایع در شیمی و ساخت موتور الکتریکی و دینام در فیزیک تنها بخشی از افتخارات او است، علاقهی زیادی به شیمی، الکتریسیته و رابطهی بین این دو داشت. این علاقه و تلاش فارادی باعث شد که شاخهایی از علوم به نام الکتروشیمی ایجاد شود. الکترون پیوند دهندهی شیمی و الکتریسیته است.
مفهوم اکسایش و کاهش:
- اکسایش یعنی آن که یک اتم یا مولکول یا یون ضمن واکنش، الکترون از دست بدهد.
- کاهش یعنی آن که یک اتم یا مولکول یا یون ضمن واکنش، الکترون دریافت کند.
باید توجه داشت هر اکسایشی با کاهشی همراه است. در هر واکنش اکسایش-کاهش، نیم واکنش اکسایش و نیم واکنش کاهش به طور همزمان صورت میگیرند.
مفهوم اکسایش ــ کاهش از دیدگاه مبادلهی الکترون
واکنش سوختن منیزیم را در نظر میگیریم. می دانیم که در این واکنش اتم منیزیم دو الکترون از دست میدهد و به کاتیون Mg تبدیل میشود این عمل از دست دادن الکترون نیم واکنش اکسایش منیزیم مینامند. در مقابل اتم اکسیژن این دو الکترون را جذب میکند و به آنیون اکسید تبدیل میشود.
این عمل گرفتن الکترون را نیم واکنش کاهش اکسیژن مینامند. نیم واکنشهای اکسایش و کاهش هم زمان روی میدهند. به عبارت دیگر در حالی که یک گونه اکسایش مییابد گونهی دیگر کاهش پیدا میکند. تفکیک واکنش اکسایش و کاهش به دو نیم واکنش نیز تنها به منظور آسان کردن درک ساز و کار این نوع واکنشهاست. همان طور که در شکل زیر مشاهده میشود واکنشهای اکسایش – کاهش باعث تبادل الکترون میشود که در نتیجه آن جریان الکتریکی تولید میشود.
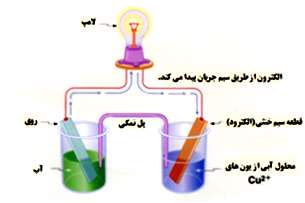
عامل اکساینده و عامل کاهنده
اکسایش و کاهش به تنهایی انجام پذیر نیستند. چون یک ماده نمیتواند کاهیده شود مگر آن که همزمان مادهای دیگر، اکسیده گردد، ماده کاهیده شده، عامل اکسایش است و بنابراین عامل اکسنده نامیده میشود و مادهای که خود اکسید میشود، عامل کاهنده مینامیم. همچنین در هر واکنش، مجموع افزایش اعداد اکسایش برخی عناصر، باید برابر مجموع کاهش شماره اکسایش عناصر دیگر باشد.
واکنش اکسایش خود به خود:
واکنش اکسایش خود به خود واکنشی است که در آن یک نوع عنصر هم اکسید و هم کاهیده میشود.
مرکز یادگیری سایت تبیان - تهیه: مرتضی عرفانیان
تنظیم: مریم فروزان کیا

















