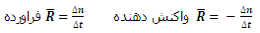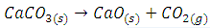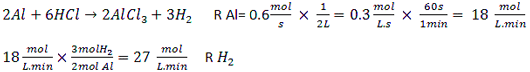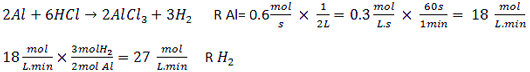سینتیک شیمیایی، سرعت واکنش های شیمیایی
در این درس، شما دانش آموزان با وارد شدن به مبحث سینتیک شیمیایی با موارد زیر آشنا خواهید شد:
- سینتیک شیمیایی
- مفهوم سرعت واکنش
- نحوه اندازه گیری آن
- تحلیل یکی از نمودارهای مربوط به سرعت واکنش
تفاوت ترمودینامیک و سینتیک
وقوع یک واکنش شیمیایی از طریق دو شاخه علم شیمی، ترمودینامیک و سینتیک بررسی می شود.
- علم ترمودینامیک «امکان» وقوع واکنش را بررسی نموده و تعیین می کند یک واکنش شیمیایی به صورت خود به خود انجام می شود یا خیر.
- در سینتیک «چگونگی» وقوع واکنش مورد بحث قرار می گیرد؛ به عبارتی سینتیک نشان می دهد اگر یک واکنش خود به خودی باشد، با چه سرعتی انجام می شود و چه عواملی روی سرعت آن تاثیرگذار هستند.
برای مثال واکنش زیر را در نظر بگیرید:
2H2(g)+ O2(g)→ 2H2O(g)
از نظر ترمودینامیکی امکان وقوع این واکنش وجود دارد اما از لحاظ سینتیکی در دمای 25 درجه سانتی گراد راه مناسبی برای انجام شدن این واکنش وجود ندارد. بنابراین خود به خودی بودن یک واکنش از دید ترمودینامیک به این معنا نیست که واکنش یاد شده بایستی سریع انجام شود.
مفهوم سرعت واکنش
سرعت واکنش کمیتی تجربی است. سرعت واکنش نسبت به یک ماده، به تعداد مول های تولید شده یا مصرف شده آن ماده در واحد زمان گفته می شود.
اگر بخواهیم سرعت واکنش را بدون در نظر گرفتن یک ماده خاص تعیین کنیم باید تعداد مول های تولید شده یا مصرف شده یک ماده شرکت کننده در واکنش را بر ضریب استوکیومتری آن ماده در معادله موازنه شده واکنش تقسیم کنیم.
در یک واکنش شیمیایی سرعت واکنش نسبت به ماده ای بیشتر است که ضریب استوکیومتری بزرگتری داشته باشد. همچمین نسبت سرعت واکنش بر حسب دو ماده مختلف در آن واکنش، برابر است با نسبت ضرایب استوکیومتری آن مواد.
در مواردی که فاز مواد شرکت کننده در واکنش گاز (g) یا محلول (aq) باشد می توان سرعت واکنش را بر حسب غلظت مولار (تعداد مول های ماده حل شونده در یک لیتر محلول) بیان کرد. یکای سرعت واکنش در این حالت mol.L-1.min-1 است. غلظت مولار یک ماده را با قرار دادن نماد یا فرمول شیمیایی آن داخل کروشه مشخص می کنند.
در واکنش زیر
سرعت واکنش مسلما نسبت به تولید CO2(g) برابر 3×10-6 mol.L-1.min-1 است. زیرا این یکا برای مواد جامد که همواره غلظتشان عددی ثابت است قابل استفاده نیست.
نمودارهای غلظت – زمان در واکنش های شیمیایی
در نمودارهای غلظت – زمان، تغییرات غلظت مواد واکنش دهنده از آن جایی که رو به مصرف هستند نزولی است. در واکنش های کامل مقدار حداقل یکی از واکنش دهنده ها به صفر می رسد و نهایتا سرعت واکنش نیز صفر می شود. اما در واکنش های تعادلی غلظت واکنش ها نه به صفر بلکه به مقدار ثابتی می رسد.نمودار تغییر غلظت فراورده ها صعودی بوده چون در حال تولیدند.
شمار اندکی از واکنش های شیمیایی همواره با سرعت ثابتی پیشرفت می کنند. پیشرفت به معنی کم شدن مقدار واکنش دهنده ها و زیاد شدن مقدار فراورده هاست. بیشتر واکنش های شیمیایی در آغاز سریع هستند. ( به جز واکنش های مرتبه صفر که در مطالب بعدی توضیح داده خواهد شد.)
در نمودارهای غلظت – زمان شیب خط مماس بر منحنی در هر نقطه سرعت واکنش را در آن لحظه مشخص می کند. لازم به ذکر است سرعت تولید فراورده ها تابع غلظت خود فراوده ها نیست. سرعت واکنش رفت، بیانگر سرعت مصرف واکنش دهنده ها و سرعت تولید فراورده ها بوده که همگی تابع غلظت مواد واکنش دهنده است.
در سوالاتی که نمودار غلظت – زمان مواد را می دهند و معادله واکنش را می خواهند، کافیست با توجه به صعودی و نزولی بودن هر منحنی، واکنش دهنده ها و فراورده ها شناخته شوند. سپس تغییرات غلظت (∆m ) مواد حساب شده و همگی بر کوچکترین ∆m تقسیم شوند تا ضرایب استوکیومتری مواد به دست آیند.
تمرین:
در واکنش فلز آلومینیم با محلول هیدروکلریک اسید، سرعت واکنش نسبت به مصرف Al در یک ظرف 2 لیتری برابر 0.6mol.s-1 است. سرعت تولید گاز H2 بر حسب mol.L-1.min-1 کدام است؟
1) 54
2) 0.9
3) 108
4) 27
مرکز یادگیری سایت تبیان – تهیه: مهسا شاه حسینی