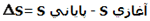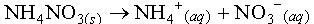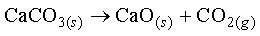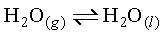آنتروپی و تعیین جهت پیشرفت واکنش های شیمیایی
آنتروپی
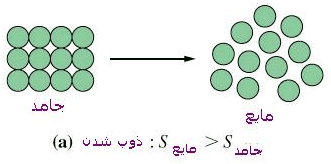
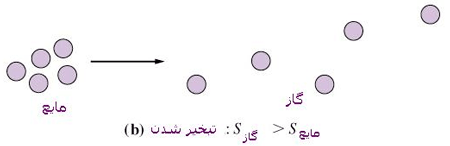
ذوب شدن یخ به طور خود به خودی صورت می گیرد. در این فرآیند بی نظمی افزوده می شود، یعنی آنتروپی زیاد می شود. در دماهای بالاتر بی نظمی بیشتر است.
برخی از تغییرهای خود به خودی سریع تر (مثل سوختن) و برخی کندتر (مثل زنگ زدن) پیش می روند. برخی از فرآیندهای فیزیکی مثل پایین آمدن آّب از آبشار نیز خود به خودی اند.
دو عامل برای خود به خودی بودن واکنش ها وجود دارد:
1- کاهش انرژی سیستم، مثل واکنش های گرماده
2- افزایش بی نظمی، مثل ذوب شدن یخ
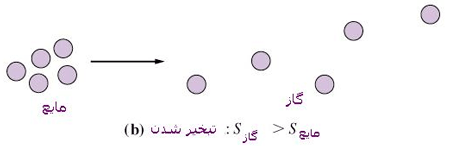
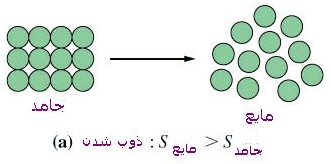
ذوب شدن یخ نه تنها گرماده نیست، بلکه از محیط گرما جذب می کند. علت خود به خودی بودن فرآیند، افزایش بی نظمی است. زیرا ملکول ها در حالت مایع بی نظم تر از جامد است.
تعداد حالت هایی که ملکول ها در حالت یخ می توانند جهت گیری کنند، محدوداست. اما در حالت مایع تعداد حالت های زیادی در دسترس است.
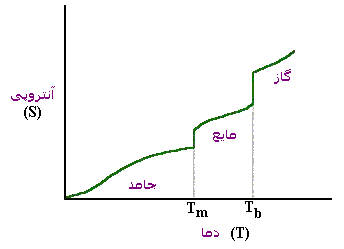
در نقطه ذوب و نقطه جوش فقط تغییر حالت داریم و افزایش دما نداریم و آنتروپی سیستم در این نقاط افزایش می یابد. برای یک بلور کامل در صفر مطلق آنتروپی صفر است.
 |
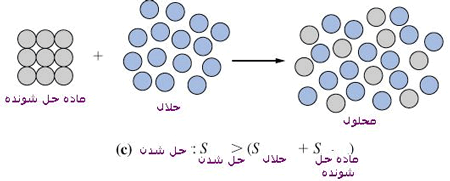
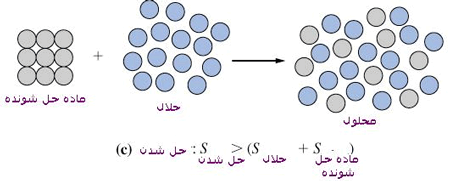
در هنگام انحلال بی نظمی افزوده می شود.
گازها وقتی در فضای بزرگتری قرار می گیرند، در این فضا پخش شده و بی نظمی آن ها بیشتر می شود بنابراین اتم های گاز ترجیح می دهند که همه ی حجم ظرف را اشغال کنند.
آنتروپی را با S نشان می دهند.
اگر در سیستم 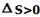 باشد. سیستم به سمت بی نظمی می رود و اگر در سیستم
باشد. سیستم به سمت بی نظمی می رود و اگر در سیستم 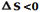 است. سیستم به سمت بی نظمی کمتر (نظم بیشتر) پیش می رود.
است. سیستم به سمت بی نظمی کمتر (نظم بیشتر) پیش می رود.
مثال 1
برای واکنش های زیر مشخص کنید، آنتروپی چگونه تغییر می کند؟
واکنش دوم به دلیل کاهش تعداد ذرات،آنتروپی کم می شود.
واکنش سوم با افزایش تعداد مول ها آنتروپی بیشتر می شود.
واکنش چهارم با تغییر فاز از گاز به مایع با افزایش نظم، آنتروپی کم می شود.
مثال
در هر كدام از موارد زیر نحوهی تغییر آنتروپی را بیان کنید؟
1- مخلوط كردن دو گاز ایدهال
2- زنگ زدن آهن
3- تصعید كربن دیاكسید
4- حل شدن نمك در آب
طبق رابطهی اكسید شدن آهنکه در زیر می بینید، تغییر آنتروپی منفی است. در بقیهی موارد تغییر مثبت است.
یک واکنش گرما گیر مثل واکنش باریم هیدروکسید با آمونیوم نیترات در حالت خشک، با هم زدن سریع به صورت خود به خودی پیش می رود، علت پیشرفت آن، افزایش بی نظمی است زیرا این مواد در یک دیگر حل شده و بی نظمی آن ها افزایش یافته است. مثل حل شدن نیترات آمونیوم در آب.
پایستگی انرژی و آنتروپی
این کلمه از "تروپی"یا کلمه "تروپوس"که یونانی است، آمده و به معنی "مقدار تحول"است. این مفهوم از آنجا آغاز شد که قانون اول ترمودینامیک به نام اصل پایستگی انرژی مطرح شد. در این اصل، پایستگی یک طرفه است: می توان هر مقدار کار را به حرارت تبدیل کرد اما نمی توان تمام گرما را به کار تبدیل کرد.
وقتی آنتروپی افزایش می یابد به تبع آن تعداد حالت های سیستم هم افزایش می یابد و افزایش تعداد حالات، بی نظمی را افزایش می دهد. پس می توانیم بگوییم: افزایش آنتروپی یعنی افزایش بی نظمی و کاهش آنتروپی یعنی افزایش نظم آنتروپی و قانون دوم ترمو دینامیک در یک فرآیند سیکلی، آنتروپی، یا افزایش می یابد یا ثابت باقی می ماند.
آنتروپی فرآیندهای طبیعی در سیستم های ایزوله زمانی خود به خودی اند که به سمت افزایش بی نظمی یا آنتروپی در سیستم حرکت کنند.
- آنتروپی معیاری برای مقدار انرژی غیر قابل تبدیل به کار است.
- آنتروپی معیاربی نظمی یک سیستم است
- آنتروپی معیاری از چند گانگی سیستم ها است
قانون دوم ترمودینامیک، قانون اول ترمودینامیک را محدود می کند. به عبارت دیگر در حین انتقال انرژی از (محل گرم به محل سرد) بخشی از آن به کار تبدیل می شود. وقتی آب از آبشار پایین می آید. بخشی از انرژی پتانسیل آن قابل تبدیل به کار است.
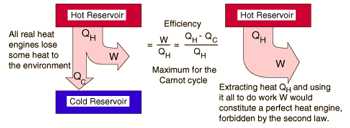
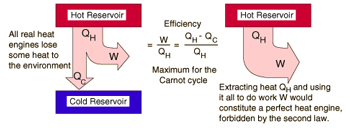
قانون دوم و موتور حرارتی
در یک موتور حرارتی در حین انتقال گرما از منبع گرم به منبع سرد بخشی از گرما به کار تبدیل می شود. معنای دوم آن است که تبدیل کل گرما به کار امکان پذیر نیست و ممنوع است. یعنی نمی توان بازده کامل داشت.
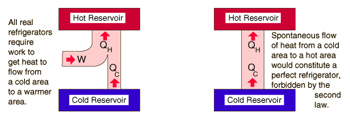
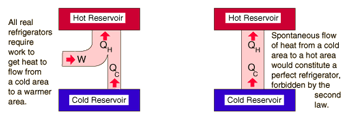
قانون دوم و یخچال
انتقال گرما از منبع سرد به منبع گرم امکان پذیر نیست. یخچال ها برای انتقال گرما از منبع سرد به گرم نیازمند کار هستند.
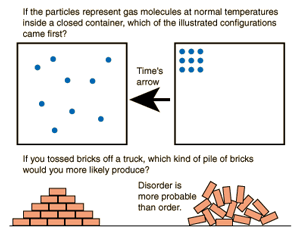
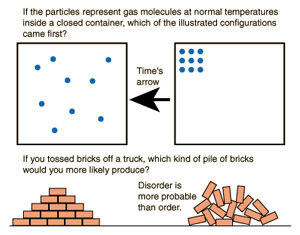
آنتروپی پیکان زمان
سیستم های ایزوله تمایل به بی نظمی دارند، اگر چند ملکول گاز را به صورت منظم در جعبه ای قرار دهید. در اثر گذشت زمان بی نظم می شوند و یا دیوار در اثر گذشت زمان تخریب و نامنظم می شود.
آنتروپی واکنش از رابطه زیر به دست می آید:
مرکز یادگیری تبیان - تهیه و تنظیم: فاطمه گودرزی