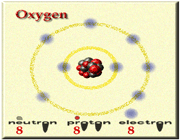
عناصر گروه دوم در جدول تناوبی (فلزات قلیایی خاکی) هریک دو الکترون والانس دارند. پس برای این که mg ، ca ، sr ، ba ساختار گاز نجیب را به دست آورند اتمهای هرعنصر باید دو الکترون از دست بدهند.
از دست رفتن دو الکترون موجب میشود که، دو پروتون در هسته خنثی نشده بماند. پس هر یون بار +2 خواهد داشت. برای جدا شدن سومین الکترون لازم است جفت الکترون های تراز اصلی با انرژی پایینتر شکسته شود. این امر انرژیِ زیادتری میخواهد. جداشدن الکترون ها از فلزات و تشکیل یون های مثبت حاصل از آن ها را میتوان به راه های مختلف ترسیم کرد.
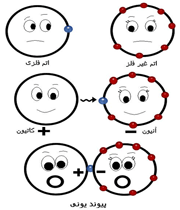
پس از جدا شدن یک الکترون از یک اتم معین، جداشدن الکترون های بعدی به ترتیب مشکل تر میشود. زیرا با از دست رفتن هر الکترون، بار مۆثر هسته زیادتر میشود و هسته، الکترون های باقیمانده را محکم تر نگاه میدارد. به طور خلاصه، یون های مثبت وقتی تشکیل میشوند که اتمهای فلزی یک الکترون (گروهIA ) دو الکترون (گروهIIA) و یا سه الکترون (گروهIIIA) به اتمهای غیر فلزی میدهند. یون های حاصل آرایش الکترونی یکسان با یک گاز نجیب دارند.
هالوژن ها
یون های مثبت، در حضور یون های منفی پایدار میشوند. خنثی شدن بار، هر دو نوع یون را پایدار میکند. یون های منفی پایدار، از اتمهایی که شش الکترون والانس دارند و هر یک، یک الکترون میخواهند تا به آرایش الکترونی هفت الکترون والانس برسند، تولید میشوند.
این گونه اتمها آن قدر الکترون بدست میآورند تا ساختار گاز نجیب را پیدا کنند. مثلا اتمهای عناصر گروه VIIA (هالوژنها) هفت آرایش یک گاز نجیب را پیدا می کنند. اگر اتمهای F ، Cl ، Br ، I هر یک، یک الکترون به دست آورند، یون های حاصل به ترتیب آرایش الکترونی گاز های نجیب را خواهند داشت.
گروه اکسیژن
اتم عناصر ششم (VIA) برای رسیدن به ساختار الکترونی یک گاز نجیب هریک دو الکترون نیاز دارند. روند به دست آوردن الکترون توسط غیرفلزات، مانند از دست دادن الکترون توسط فلزات را میتوان به راه های متفاوت ترسیم کرد. به طور خلاصه غیرفلزات یک، دو یا سه الکترون از فلزات میگیرند و یون منفی ایجاد میکنند این یون های منفی همگی الکترون های والانس جفت شده و آرایش هشت الکترونی پایدار گازهای نجیب را دارند.
فرمول شیمیایی مواد مرکب یونی
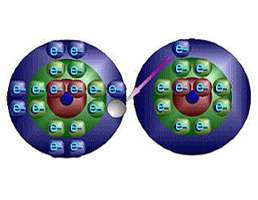
فرمول شیمیایی یک ماده مرکب از لحاظ الکتریکی خنثی است. خنثی بودن الکتریکی مستلزم آن است که شمار بارهای مثبت و منفی در بلور ماده مرکب برابر باشند. در بلور نمک طعام یون های با جاذبه الکتریکی میان بارهای مخالف درجای خود نگاه داشته شدهاند.
علاوه بر این برای خنثی بودن این ماده مرکب باید نسبت یون های سدیم به یون های کلرید 1 به 1 باشد. در این صورت سادهترین فرمول آن خواهد بود. در ساختار بلورین هر یون سدیم با هر شش یون کلرید اطراف آن جذب میشود. به همین طریق هر یون کلرید با هر شش یون سدیم اطراف آن جذب میشود در ساختارهای یونی هیچ مولکول تک اتمی وجود ندارد، یعنی هیچ یون خاصی وجود ندارد که منحصرا به یک یون دیگر بپیوندد.
مرکز یادگیری تبیان - تهیه و تنظیم: فاطمه گودرزی