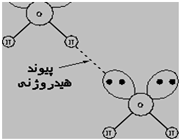
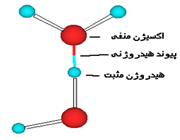
پیوند هیدروژنی
جاذبه بین مولکولی دربرخی از ترکیبات هیدروژندار به طور غیرعادی قوی است این جاذبه در ترکیباتی مشاهده میشود که درآن ها بین هیدروژن و عناصری که اندازه کوچک و الکترونگاتیوی زیاد دارند پیوند هیدروژنی وجود دارد. پیوند هیدروژنی نه تنها بین مولکول های یک نوع ماده، بلکه بین مولکول های دو ماده متفاوت که توانایی تشکیل پیوند هیدروژنی را دارند نیز برقرار میشود.
تعریف پیوند هیدروژنی Hydrogen Bond
هرگاه هیدروژن به اتمی با الکترونگاتیوی زیاد مثل فلوئور، اکسیژن یا نیتروژن متصل گردد، شرایطی برای به وجود آمدن نوع بسیاری مهمی جاذبه بین مولکولی مثبت ـ منفی حاصل میشودکه به آن پیوند هیدروژنی میگویند.
به عبارت دیگر، اتم یک مولکول هیدروژن و زوج الکترون غیر مشترک مولکول دیگر متقابلا همدیگر را جذب میکنند و پیوندی تشکیل میشود که به پیوند هیدروژنی مرسوم است.
نحوه تشکیل پیوند هیدروژنی
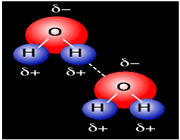
جا به جا شدن یک جفت الکترون به سمت عنصر بسیار الکترونگاتیو نیتروژن، اکسیژن یا فلوئور باعث میشود که این اتم ها دارای بار منفی جزئی شوند. در این صورت پیوند هیدروژنی پلی است میان دو اتم شدیدا الکترونگاتیو با یک اتم هیدروژن که از طرفی به طور کوالانسی با یکی از اتم های الکترونگاتیو و از طرف دیگر بطور الکترواستاتیکی (جاذبه مثبت به منفی) با اتم الکترونگاتیو دیگر پیوند یافته است.
استحکام پیوند هیدروژنی یک دهم تا یک پنجاهم قدرت یک پیوند کوالانسی متوسط است.
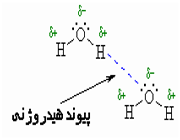
شرایط تشکیل پیوند هیدروژنی
1. بالا بودن الکترونگاتیوی اتم های متصل به هیدروژن
برهمین اساس است که فلوئور (الکترونگاتیوترین عنصر) قویترین پیوند هیدروژنی را تشکیل می دهد و اکسیژن (الکترونگاتیوتر از نیتروژن) پیوند هیدروژنی قویتری درمقایسه با نیتروژن تشکیل میدهد.
هم چنین بار مثبت زیاد بر روی اتم هیدروژن، زوج الکترون مولکول دیگر را به شدت جذب میکند و کوچک بودن اندازه اتم هیدروژن سبب میشود که ملکول دوم بتواند به آن نزدیک شود.
2. کوچک بودن اتم های متصل به هیدروژن
پیوند هیدروژنی واقعا مۆثر فقط در ترکیبات فلوئور، اکسیژن و نیتروژن تشکیل میشود. با وجود این که دو اتم نیتروژن و کلر الکترونگاتیوی برابر دارند چون اتم کلر از اتم نیتروژن بزرگ تر است بر خلاف نیتروژن، کلر پیوند هیدروژنی ضعیفی تشکیل میدهد.
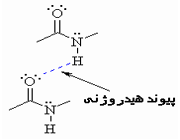
توجیه خواص غیرعادی برخی از مواد
وجود خواص غیرعادی برخی از مواد در حالت جامد یا مایع از جمله بالا بودن دماهای ذوب و جوش، نشان میدهد که نیروهای جاذبه بین مولکولی در آن ها به اندازهای زیاد است که نمیتوان آن را به تأثیرهای متقابل ضعیف بین مولکولی نسبت داد. آشناترین این نوع مواد فلوئورید هیدروژن، آب و آمونیاک است که بسیاری از خواص آن ها از جمله دماهای جوش و ذوب آن ها از دماهای جوش و ذوب ترکیب های مشابه خود به طور غیرمنتظرهای بالاتر است.
شاید تصور شود که علت این وضعیت غیر عادی، قطبیت به نسبت زیاد این مولکول هاست؛ البته تا اندازهای همین طور است، اما بررسی دقیق این پدیده غیر عادی نشان میدهد که باید نیروی جاذبه قوی تر از نیروهای جاذبه دوقطبی _ دوقطبی بین مولکول های آن ها برقرار باشد.
اگر به ساختار الکترونی مولکولی آن ها توجه شود، میتوان به موردهای مشترک بین آن ها پی برد:
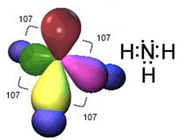
این وجه اشتراک، وجود دست کم یک پیوند کوالانسی با اتم هیدروژن و یک اوربیتال هیبریدی ناپیوندی دو الکترونی اتم مرکزی بسیار الکترونگاتیو در هر یک از آن هاست
اتم هایی که الکترونگاتیوی بالایی دارند با هیدروژن پیوند کوالانسی به شدت قطبی به وجود میآورند به طوری که هیدروژن به میزان قابل توجهی خصلت یک پروتون را پیدا میکند.
جفت الکترون ناپیوندی و قابل واگذاری روی اتم H، این امکان را پدید میآورد که اتم هیدروژن در نقش پل، اتمهای الکترونگاتیو دو مولکول را به یکدیگر متصل کند و نیروی جاذبه بین مولکولی بوجود میآید که به پیوند هیدروژنی مرسوم است.
مرکز یادگیری تبیان - تهیه و تنظیم: فاطمه گودرزی