پیوند فلزی تعریف پیوند فلزی
توجیه پیوند فلزی
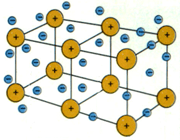
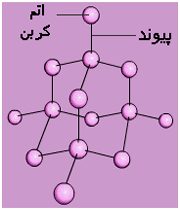
انرژی یونش فلزات نسبت به غیر فلزات نسبتا کمتر و تعداد اوربیتال های خالی لایه ظرفیت اتم آن ها نسبت به تعداد الکترون های لایه ظرفیت نیز کم است. از این رو، تعدادی از الکترون های سست لایه ظرفیت اتم فلز که در اصطلاح دریای الکترون فلزی نیز نامیده میشوند، باقیمانده اتم های فلز را که دارای بارمثبت خواهند بود، فرا میگیرد. جاذبه الکتروستاتیکی بین این ذرههای مثبت فلزی و بارمنفی توده ابر الکترونی آزاد فلزی به وجود می آید که سرتاسر شبکه بلور فلز را گرفته است.
پیوند فلزی
جاذبه الکتروستاتیکی حاصل بین ذرههای مثبت فلزی و بارمنفی توده ابر الکترونی آزاد، عامل پیوند بین ذرههای فلز محسوب میشود و اتصال ذرههای فلز را در شبکه و انسجام بلور فلزی را تأمین میکند. چون چنین پیوندی دارای جهت خاصی نیست و ذرههای فلز نیز امکان جابجا شدن در داخل توده ابر الکترون آزاد فلزی را در شبکه بلور دارند، از این رو، به روشنی میتوان بسیاری ازخواص ویژه مکانیکی فلزها، مانند قابلیت چکش خواری، مفتول شدن، تورق و غیره را توجیه کرد.
توجیه خواص فلزات با پیوند فلزی
1. رسانایی الکتریکی
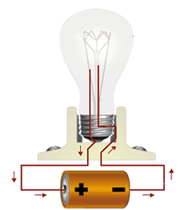
جریان برق نتیجه جابجایی الکترون است. وقتی دو سر سیم برق رابه یک تکه فلز متصل کنیم از قطب مثبت جریان تعدادی الکترون از فلز خارج میشود، این کمبود الکترونی بر الکترون های غیرمستقر در فلزات اثر گذاشته، آن ها را به سمت خود میکشند. این امر باعث میشود که همان تعداد الکترون که از یک طرف خارج شده بود از طرف دیگر وارد شود و به این وسیله جریان الکتریسته انتقال یابد.
2. رسانایی گرمایی
بر اثر گرم کردن فلز، جنبش الکترون های غیر مستقر افزایش مییابد و این جنبش از یک گوشه فلز به سایر قسمت های آن منتقل میشود.
3. درخشندگی و جلای فلزات
تابش نور به سطح فلز باعث میشود که الکترون های غیر مستقر در سطح فلز برانگیخته شده و به ترازهای بالاتر انرژی بروند. بازگشت این الکترون ها باعث میشود که امواج نور مرئی از سطح فلز بازتابیده شود. در مورد فلزات رنگین بازگشت الکترون ها تنها طول موج معینی را که مربوط به رنگ فلز است بازتاب میکند.
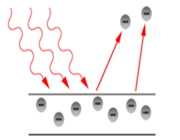
4. پدیدههای فوتوالکتریک و ترموالکتریک
وقتی انرژی کافی (نورانی یا گرمایی) به فلز داده شود برانگیخته شدن الکترون بدان حد میرسد که الکترون از فلز جدا شود. هرگاه دستگاه مناسبی فراهم کنیم میتوانیم الکنرون جدا شده را درمدار به جریان در آورده الکتریسته تولید کنیم.
5. چکش خواری
وقتی ضربهای به فلز وارد میشود یون های مثبت در دریای الکترون منفی جابجا میشوند ولی دریای بار منفی پیوستگی تکه فلز را حفظ میکند.
طول و شعاع پیوند فلزی
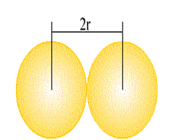
در مورد فلزها اصطلاح طول پیوند فلزی، به فاصله تعادلی بین هسته دو اتم مجاور در شبکه بلور فلزها اطلاق میشود. بر حسب قرار داد نصف طول پیوند فلزی را شعاع فلزی مینامند که گاهی شعاع اتمی فلز نیز نامیده میشود.
باید توجه داشت که شعاع فلزی به سیستم بلوری فلز وابستگی دارد. یعنی اگر فلزی در چند سیستم متمایز متبلور شود شعاع فلزی آن در سیستم های گوناگون یکسان نخواهد بود. بررسیها و محاسبهها نشان داده است که هرچقدر عدد کوئوردیناسیون اتم فلز در شبکه بلور بزرگ تر باشد طول شعاع فلزی آن افزایش می یابد.
با توجه به این که در پیوند فلزی بر خلاف پیوند کوالانسی همپوشانی بین اوربیتال های دو اتم صورت نمیگیرد، انتظار میرود که طول پیوند کوالانسی آن بیش تر باشد که تجربه نیز چنین رویدادی را تأیید میکند. بدیهی است که شعاع فلزی نیز از شعاع کوالانسی بزرگتر است.
شعاع اتمی فلز قلیایی در هر دوره نسبت به شعاع اتمی عنصرهای دیگر آن دوره به نسبت بزرگتر است
پس از فلزات قلیایی خاکی در هر دوره بویژه از دوره چهارم به بعد اندازه شعاع اتمی به شدت کاهش مییابد.
این کاهش شدید اندازه شعاع را باید از یک طرف به بالا بودن سطح تراز S لایه ظرفیت اتم عنصرهای قلیایی خاکی و قلیایی و پایین بودن سطح تراز d لایه ظرفیت فلزات واسطه و گسترده بودن اوربیتال های d در این عنصر مثبت داد. زیرا به دلیل عمقی و گسترده بودن اوربیتال های d، ابر بار الکترون ها در آن ها گسترده است و اثر پوششی ناچیزی در مقابل تأثیر بار هسته اتم برلایه خارجی اتم اعمال میکنند.
از این رو بر اثر بالا رفتن بیش ازحد انتظار مقدار بار مۆثر هسته اتم فلزهای واسطه اندازه شعاع آن ها به شدت کاهش مییابد.
روند تغییر اندازه شعاعها در مورد فلزهای واسطه هر دوره جالب توجه و برخلاف روند عادی آن در مورد تغییر شعاع عنصرهای اصلی در دوره هاست. البته این روند به وضعیت الکترونی ویژه آن ها بستگی دارد. با توجه به قابلیت انعطاف و تغییر شکل ناپذیری که نتیجه قابلیت تحرک پیوند فلزی است انتظار میرود که قدرت پیوند بین دو اتم فلز در بلور فلزی از قدرت پیوند کوالانسی بین دو اتم آن در حالت گازی کم تر باشد.
انرژی پیوند فلزی
اندازه گیری گرمای تفکیک نشان میدهد که انرژی مولی پیوند فلزی در شبکه بلوری از انرژی مولی تفکیک پیوند کوالانسی آن به صورت مولکول دو اتمی بیش تر است. این رویداد را این طور میتوان توجیه کرد که پیوند فلزی به تعداد نامحدود در تمام راستا در شبکه بلور فلزی تشکیل میشود در صورتی که چنین وضعیتی در حالت گازی فلزها وجود ندارد.
از این رو با وجود این که بلور فلزی پیوستگی و پایداری زیادی دارد و پیوند فلزی در مجموع پیوندی قوی محسوب میشود. بدیهی است در هر گروه با افزایش عدد اتمی و بزرگ تر شدن طول پیوند فلزی انرژی پیوند و گرمای تفکیک مولی فلز کاهش می یابد.
مرکز یادگیری تبیان - تهیه و تنظیم: فاطمه گودرزی