اوربیتال مولکولی 1
هنگام ایجاد یک پیوند بین دو اتم، اوربیتالهای اتمی آن ها با یکدیگر همپوشانی کرده و اوربیتالهای مولکولی را پدید میآورند. در این اوربیتالها، الکترونها در یک محیط مولکولی تحت تاثیر دو هسته قرار دارند و بر حسب قاعده آفبا در این اوربیتالها چیده میشوند.اوربیتالهای مولکولی را با توجه به این که از همپوشانی کدام اوربیتال اتمی پدید آمده باشند،باحروف یونانی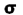 (سیگما) و
(سیگما) و 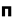 (پی) نمایش میدهند.
(پی) نمایش میدهند.
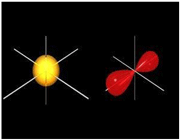
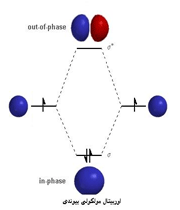
هنگام تشکیل یک پیوند، دو اوربیتال مولکولی حاصل میشود که با توجه به سطح انرژی، نسبت به اوربیتالهای اتمی به اوربیتالهای مولکولی پیوندی و ضد پیوندی شهرت دارند. به همان اندازه که اوربیتال مولکولی پیوندی، مولکول را پایدار میکند، اوربیتال مولکولی ضد پیوندی باعث ناپایداری پیوندی میشود.
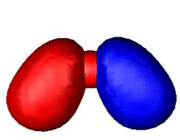
اوربیتال پیوندی
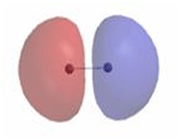
اوربیتال ضد پیوندی
در این نظریه برعکس نظریه پیوند (که فقط دخالت لایه ظرفیت اتمها را در تشکیل پیوند در نظر میگیرد) تمام اوربیتال های اتم میتواند در تشکیل اوربیتال های مولکولی شرکت داشته باشد و این اوربیتال ها بین چندین اتم و حتی در سراسر مولکول گسترده یا غیر مستقرند.
علاوه بر اوربیتال های پیوندی و غیر پیوندی، اوربیتال های ضد پیوندی نیز در تشکیل پیوند و توجیه پایداری و یا ناپایداری مولکول در نظر گرفته میشود و به تعداد اوربیتال های اتمی شرکت کننده، اوربیتال های مولکول تشکیل میشود.
شرایط همپوشانی اوربیتال ها
برای اینکه اوربیتال های اتمی بتوانند در حد تشکیل پیوند با یکدیگر همپوشانی کنند، باید دو شرط زیر درباره آن ها برقرار باشد:
مثلا اوربیتال 3P یک اتم کلر می تواند فقط با اوربیتال 3P اتم دیگر کلر همپوشانی کند. اوربیتال S اتم H نمیتواند با اوربیتال 1S یا 2S و … اتم کلر همپوشانی کند، زیرا در سطح انرژی بالاتری نسبت به آنها قرار دارد.
انواع اوربیتال های مولکولی
اوربیتال مولکولی پیوندی
اوربیتال مولکولی پیوندی اوربیتال مولکولی است که در آن چگالی در ناحیه بین هستهها زیاد است. انرژی دو الکترون که در اوربیتال مولکولی پیوندی قرار میگیرند، کمتر از هنگامی است که در اوربیتال های اتمی به وجود آورنده آن، قرار گرفته باشند.
اوربیتال مولکولی ضد پیوندی
اوربیتال مولکولی ضد پیوندی اوربیتال مولکولی است که در آن چگالی الکترونی در ناحیه بین هستهها کم است. انرژی دو الکترون که در اوربیتال مولکولی ضد پیوندی قرار میگیرند، بیشتر از هنگامی است که در اوربیتال های اتمی به وجود آورنده آن، قرار گرفته باشند.
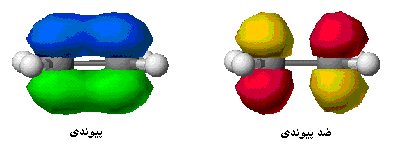
هر گاه دو اتم نتوانند به طریقی به هم نزدیک شوند که امکان همپوشانی اوربیتال های آن ها به وجود آید، همپوشانی اوربیتال ها صورت نمیگیرد و در نتیجه اوربیتال های اتمی به صورت غیر پیوندی در مولکول باقی خواهند ماند. اوربیتال های مولکولی را نیز با حروف یونانی 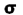 (سیگما) ،
(سیگما) ، 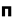 (پی) و ... نشانه گذاری میکنند.
(پی) و ... نشانه گذاری میکنند.
مرکز یادگیری تبیان - تهیه و تنظیم: فاطمه گودرزی