مدل های اتمی 1
1.مدل دموکریت
1. ماده ساختار ذره ای دارد
2. اتم های مواد مختلف شکل های متفاوتی دارند (اتم های مواد ترش لوزی شکل و اتم های آب کروی)
2. مدل دالتون
1. ماده ساختار ذره ای دارد 2. اتم ساچمه مانند و توپر است 3. تفاوت مواد بخاطر شکل اتم های آن ها نیست.
3. مدل تامسون
1. اتم دارای بار منفی به نام الکترون است و به همان اندازه بار مثبت به نام پروتون دارد.
2. الکترون ها در خمیری از بارهای مثبت پخش شده اند مانند کیک کشمشی
4. مدل رادرفورد
1. اتم هسته ای کوچک با بار مثبت دارد
2. بیشتر حجم اتم فضای خالی است
3. الکترون ها اطراف هسته را محاصره کرده اند.
5.مدل بور
1. هسته کوچک با بار مثبت 2. الکترون ها به دور هسته روی مسیر دایره ای شکل می چرخند 3. تعداد الكترونهای هر مدار ثابت، از مداری به مدار دیگر تغییر می كند.
توضیحات فوق خلاصه ای از سیر نظریه ها در مورد ماده و اتم است، حال به تشریح آن می پردازیم:
در رم باستان دالتون بر این عقیده بود که اتم کوچک ترین جزء غیر قابل تجزیه ماده است و نمی توان آنرا به اجزای کوچکتری تقسیم کرد.
در اواسط قرن نوزدهم عده ای از دانشمندان با انجام آزمایش هایی تقسیم ناپذیر بودن اتم را رد كردند و پی بردند كه اتم از ذرات بسیار ریزی تشكیل شده است ( ذرات سازنده اتم به زیر اتمی معروف بود). برای نخستین بار جوزف تامسون با استفاده از لامپ پرتو كاتدی به ماهیت زیر اتمی ها پی برد.
وی به دو سر الكترود مثبت و منفی لامپ اختلاف پتانسیل الكتریكی وصل كرد و مشاهده كرد كه، پرتو كاتدی از الكترود منفی (كاتد) به الكترود مثبت (آند) می رود. در مسیر پرتو كاتدی میدان مغناطیسی قرار داد و مشاهده كرد كه پرتو كاتدی به سمت قطب مثبت منحرف می شود. هم چنین در این مسیر، توربین پرّه دار قرار داد و بر اثر برخورد پرتو به توربین، توربین شروع به حركت می كرد.
وی با تكیه بر آزمایش های خود به این نتیجه رسید كه ذرات سازنده پرتو كاتدی، دارای بارالكتریكی منفی هستند و هم چنین، علاوه بر ماهیت موجی كه پرتو دارد، ماهیت ذره ای نیز از خود نشان می دهد.
تامسون این ذرات منفی را الكترون نامید و بعدها دریافت كه ذرات سازنده پرتو كاتدی (الکترون) در تمام مواد وجود دارند.
وی با استناد بر استنتاج های خود نظریه اتمی خود را مطرح ساخت. مطابق این مدل، اتم از بار الكتریكی منفی ( الكترون ) و بار الكتریكی مثبت تشكیل شده است كه به صورت یكنواخت در سراسر اتم پخش شده است.
مدل اتمی رادرفورد:
در سال 1911 رادرفورد با انجام آزمایشی، مدل اتمی تامسون را رد کرد. او در آزمایش خود، پرتو آلفا را که دارای بار الکتریکی منفی است به ورقه نازک طلا گسیل داد. بر اثر این برخورد، بخش عظیمی از پرتو از ورقه عبور کرد، اما قسمت ناچیزی از آن براثر بر خورد منعکس و یا منحرف شد.
وی با تکیه بر این استنتاج، مدل اتمی خود را به این صورت بیان کرد که: بخش عظیمی از فضای اتم خالی است و به همین دلیل بخش عظیمی از پرتو آلفا بدون انحراف از اتم عبور می کند، اما قسمت ناچیزی از اتم توپر و متراکم است که دارای بار الکتریکی مثبت است و هنگامی که پرتو آلفا به آن برخورد می کند منعکس می شود و یا هنگامی که از نزدیکی آن عبور می کند منحرف می شود.
در اطراف این منطقه ی توپر "هسته اتم" الکترون ها پراکنده شده اند و علت آن که چرا هنگامی که پرتو آلفا از فضای اطراف هسته عبور می کند و از کنار الکترون ها بدون هیچ انحرافی به مسیر خود ادامه می دهند، آن است که در یک اتم اندازه بارالکتریکی مثبت هسته با مجموع اندازه بار الکتریکی منفی الکترون های اطراف آن برابر است. پس مطابق مدل اتمی رادرفورد، اتم از هسته که دارای بار الکتریکی مثبت است و در مرکز اتم قرار دارد و هم چنین الکترون که در اطراف هسته قرار دارد، تشکیل شده است.
برای آشنایی بیشتر با مدل اتمی رادرفورد می توانید این فلش را ببنید.
مدل بور: با پذیرفتن مدل اتمی رادرفورد این سوال برای دانشمندان پیش آمد: که
طیف نشری خطی اتم عناصر، حاصل از چیست ؟
(هر فلز طیف نشری خطی خاص خود را داراست و مانند اثر انگشت می توان از این طیف برای شناسایی فلز مورد نظر بهره گرفت)
از طرف دیگر مدل اتمی رادرفورد الكترون ها را در حال چرخش به دور هسته فرض كرد. در حالی كه الكترون ذرهی دارای بار الكتریكی است و بر اساس قوانین الكترودینامیك حركت شتاب دار ذرات دارای بار الكتریكی از جمله الكترون با انتشار امواج الكترو مغناطیسی و در نتیجه كاهش انرژی ذرهی متحرك همراه است. بنابراین الكترون ضمن چرخش به دور هسته باید به تدریج و مارپیچوار به هسته نزدیک شده و جذب هسته شود در صورتی که واقعیت غیر از این است بنابراین مدل اتمی رادرفورد ارزش خود را از دست میدهد.
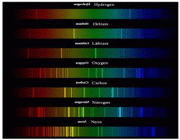
مدل اتمی بور توانست به ما نشان دهد که طیف نشر خطی که از اتم عناصر گسیل می شود:
که اگر این نور آزاد شده را از منشور عبور دهیم طیف نشری آن مشخص می شود.
مرکز یادگیری تبیان- تهیه و تنظیم: فاطمه گودرزی




















