
مدل بوهر و ترازهای انرژی
در این مطلب نگاهی به مدل بوهر، مدارهای انرژی الکترونی، جذب و نشر فوتون و نقایص و موفقیت های مدل بوهر خواهیم داشت. ضمنا در فلش آموزشی زیر خواهید دید که مدل بوهر برای اتم هیدروژن، نشر و تحریک فوتون را چگونه نمایش می دهد.
مدل بوهر شامل یک هسته کوچک با بار مثبت است که الکترون هایی با بار منفی به دور آن می چرخند. در این مطلب نگاه دقیق تری به این مدل خواهیم انداخت که گاهی به نام مدل "بوهر – راترفورد" هم نامیده می شود.
نگاه کلی به مدل بوهر:
مدل بوهر برای اتم ها توسط نیلز بوهر در سال 1915 ارائه شد. به دلیل این که مدل بوهر، اصلاح کننده مدل قدیمی تر راترفورد است، برخی مردم این مدل را بوهر- راترفورد می نامند. این در حالی است که مدل امروزی و پیشرفته برای اتم بر اساس مکانیک کوانتومی بنا شده است. مدل بوهر با این که نقایصی دارد ولی به دلیل این که ریاضیات بسیار پیشرفته تئوری اتمی کونتومی را ندارد، بسیار ساده و قابل درک است. برخلاف مدل های قبل از بوهر، مدل بوهر، فرمول ریدبرگ برای خطوط نشری طیف اتمی هیدروژن را می تواند توضیح دهد.
مدل بوهر نوعی مدل سیاره ای شکل است که الکترون های با بار منفی به دور هسته ای با بار مثبت می چرخند و این وضعیت مانند چرخش سیارات به دور خورشید است (البته مدارهای چرخش در مدل بوهر، مسطح نیستند). نیروی گرانشی منظومه شمسی با نیروی الکتریکی کولنی بین بارهای مثبت هسته و بارهای منفی الکترون ها یکسان است.
نکات اصلی مدل بوهر:

الکترون ها در مدار هایی که اندازه دقیق و انرژی معینی دارند، دور هسته می جرخند.
 انرژی مدار با اندازه آن مدار رابطه دارد. کم ترین انرژی در کوچک ترین مدار یافت می شود.
انرژی مدار با اندازه آن مدار رابطه دارد. کم ترین انرژی در کوچک ترین مدار یافت می شود. زمانی که الکترونی از مداری به مدار دیگر حرکت می کند، تابشی (از جنس فوتون) جذب یا نشر می شود.
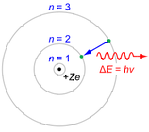
زمانی که الکترونی از مداری به مدار دیگر حرکت می کند، تابشی (از جنس فوتون) جذب یا نشر می شود.مدل بوهر برای هیدروژن:
مثال ساده برای مدل بوهر با Z=1 برای اتم هیدروژن یا یون شبیه هیدروژن (Z>1) بیان می شود. اگر الکترونی ار مداری به مدار دیگر حرکت کند، انرژی الکترومغناطیسی، جذب یا منتشر خواهد شد. در این حرکت الکترونی از مداری به مدار دیگر، فقط مدارهای معین الکترونی مجاز خواهند بود. شعاع مدارهای مجاز با n2 که n عدد کوانتومی اصلی است، افزایش پیدا می کند. گذار (جهش) الکترون از مدار 3 به 2، اولین خط سری بالمر را تولید می کند. برای هیدروژن (Z=1) این گذار، فوتونی با طول موج 656 nm (نور قرمز) تولید می کند.
همان گونه که در این فلش نیز می بینید، انرژی فوتون تحریکی از مقدار 10.2 الکترون ولت تا 12.8 الکترون ولت است. تراز های جهش های نشری الکترون نیز به صورت تصادفی اند. به عنوان مثال، هنگامی که الکترون در تراز n=1 (حالت پایه) به دور هسته می چرخد، با جذب فوتونی که انرژی پرش به تراز 2 با انرژی 10.2 الکترون ولت را تأمین می کند، به تراز 2 پرش می کند و سپس با نشر(گسیل) این فوتون، انرژی اضافی خود را از دست داده و به تراز 1 برمی گردد. مقدار انرژی گرفته شده برای تحریک الکترون با انرژی که الکترون از دست می دهد تا به حالت اول برگردد، برابر است.
مشکلات مدل بوهر:

این مدل برای الکتورن ها شعاع و مدار مشخصی در اطراف هسته در نظر می گیرد در حالی که در شیمی آموخته اید که مکان دقیق الکترون در اطراف هسته را نمی توان معین کرد (به مطلب ابر الکترونی مراجعه شود). به این واقعیت که مکان الکترون در اطراف هسته را نمی توان به دقت تعیین کرد،"اصل عدم قطعیت هایزنبرگ" گفته می شود.

پیش بینی های ضعیفی برای طیف اتم های بزرگ تر در نظر می گیرد.

شدت های نسبی خطوط طیف را پیش بینی نمی کند.

در مدل کوانتومی برای اتم و ساختار آن می توان با استفاده از خوط طیف، ساختار ریز و فوق ریز اتم ها را مشخص کرد ولی در مدل بوهر برای این واقعیت، توضیحی وجود ندارد.

این مدل، اثر زیمان را نمی تواند توضیح دهد.
مرکز یادگیری سایت تبیان - تهیه و تنظیم : خدیجه آلچالانلو

















