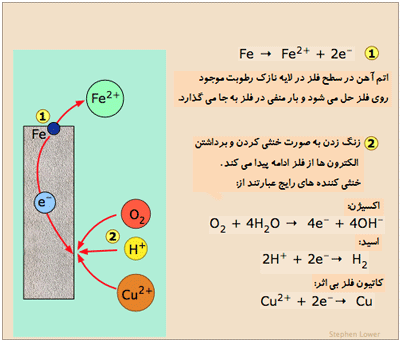
یک فرایند الکتروشیمیایی : زنگ زدگی

زنگ زدن به معنی تحلیل و پوسیدگی مواد توسط فرایند شیمیایی است. مهم ترین فرایند زنگ زدن، پوسیدگی شیمیایی فلزات است که فرایند اکسایش فلز M → M+ + e– در حضور یک پذیرنده مناسب الکترون اتفاق می افتد.

می توان گفت که زنگ زدن همان بازگشت خود به خودی فلز به سنگ معدن خود است؛ این فرایند (در حالت ساده و عادی) بدون حضور آب نمی تواند اتفاق بیفتد (البته وجود لایه نازکی رطوبت بر روی فلز هم برای انجام این عمل کافی است)، برای همین مانع انواع دیگر عوامل خوردگی مانند اکسایش در دمای بالا یا سولفیده شدن (اتصال شیمیایی یک اتم گوگرد به یک ماده مرکب) می شود.
در این واکنش یک فلز با محیط اطراف خود واکنش می دهد تا اکسید یا مواد مرکب دیگر تشکیل دهد. سلولی که باعث این فرایند می شود، سه جزء اصلی دارد:
یک آند، یک کاتد و یک الکترولیت (محلولی که جریان الکتریسیته را هدایت می کند).
آند قسمتی است که فلز در آن قسمت دچار پوسیدگی و زنگ زدگی می شود. الکترولیت، محیطی است که باعث عمل خوردگی و پوسیدگی می شود و کاتد (قسمتی از سطح همان فلز یا سطح یک فلز دیگر که در تماس با فلز پوسیده است) الکترود (قطب دیگری) در سلول تشکیل می دهد و در طی فرایند زنگ زدن دچار خوردگی نشده و مصرف نمی شود.
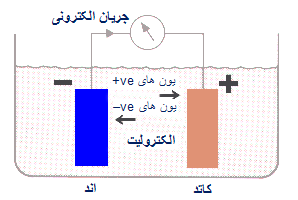
سطح یک فلز ممکن است آند شود و جزء دیگر در تماس با آن، کاتد خواهد بود.
معمولا تعداد سلول های زنگ زدگی زیاد است و به صورت اجزای کوچک در نقاط مختلف سطح همان جزء از فلز به وجود می آیند.
آندها و کاتدها ممکن است به دلیل تفاوت فازهای اجزا خود فلز ، تفاوت در رسوب یا روکش های روی سطح فلز یا تفاوت در الکترولیت به وجود بیایند.
سرعت فرایند زنگ زدن به طور قابل توجهی به رسانندگی الکتریکی محلول الکترولیت آن بستگی دارد. آب خالص، رسانندگی الکتریکی ضعیفی دارد و سرعت زنگ زدن با این الکترولیت، خیلی کم تر از محلول اسیدی (با رسانندگی بالا) خواهد بود.
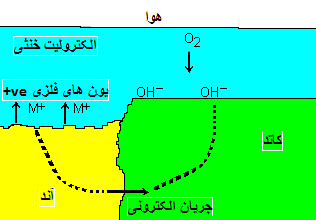
Fe(s) → Fe2+(aq) + 2 e–
و فرایند کاتدی می تواند هر کدام از این واکنش ها باشد:O2 + 2 H2O + 4e– → 4 OH– H+ + e– → ½ H2(g) M2+ + 2 e– → M(s)
مرکز یادگیری سایت تبیان - تهیه و تنظیم: خدیجه آلچالانلو