
محلولسازی

روش ساخت محلول با غلظت معین
بسیاری از واکنشهای شیمیایی تنها در محیط آبی قابل انجام هستند و برخی دیگر در محیط آبی بهتر انجام میشوند و در نتیجه باید اجزای واکنش در آب یا حلال دیگری حل شود. دلیل این امر جنبش مولکولهای مایعات و تراکم خوب آن است که باعث میشود احتمال برخورد مولکولهای دخیل در واکنش زیاد شود و واکنش بهتر و سریعتر انجام شود.
احتمالاً در تصاویر قدیم، کیمیاگران را دیدهاید که مشغول ساختن محلولهای گوناگون و رنگارنگ هستند.

محلولسازی شامل حلشدن یک مادهی حلشونده (جامد، مایع، گاز) در یک مایع حلال است. حلال میتواند آب یا هر مایع دیگری باشد که قابلیت حلکردن حلشونده را داشته باشد. برای انجام آزمایشهای علمی لازم است مقدار دقیق حلشونده در حلال معلوم باشد. تیترسنجی، واکنشهای خنثیسازی و واکنشهای اکسیداسیون و احیا از جمله مواردی هستند که با محلولسازی سروکار دارند.
 برای وزنکردن مواد جامد از یک ظرف تخت مثل پتری یا یک تکه کاغذ تمیز و صاف استفاده کنید. آن را روی ترازو بگذارید و در صورت امکان سنجهی ترازو را صفر کنید. اگر ترازو چنین امکانی ندارد، وزن آن را یادداشت کنید و از وزن کل کم کنید. پودر را روی آن بریزید تا به وزن موردنظر شما برسد. با توجه به وزن موردنیاز، ماده را با سرعت کم یا زیاد بریزید. سعی کنید بیشتر از مقدار موردنیاز ماده را از ظرف آن خارج نکنید تا مجبور به بازگرداندن آن نباشید. به این روش احتمال آلودهشدن و ناخالصی ماده را کاهش میدهید. اگر از قاشق مخصوص (اسپاتول) استفاده میکنید، قاشقهای آغشته به مواد گوناگون را برای یکدیگر استفاده نکنید.
برای وزنکردن مواد جامد از یک ظرف تخت مثل پتری یا یک تکه کاغذ تمیز و صاف استفاده کنید. آن را روی ترازو بگذارید و در صورت امکان سنجهی ترازو را صفر کنید. اگر ترازو چنین امکانی ندارد، وزن آن را یادداشت کنید و از وزن کل کم کنید. پودر را روی آن بریزید تا به وزن موردنظر شما برسد. با توجه به وزن موردنیاز، ماده را با سرعت کم یا زیاد بریزید. سعی کنید بیشتر از مقدار موردنیاز ماده را از ظرف آن خارج نکنید تا مجبور به بازگرداندن آن نباشید. به این روش احتمال آلودهشدن و ناخالصی ماده را کاهش میدهید. اگر از قاشق مخصوص (اسپاتول) استفاده میکنید، قاشقهای آغشته به مواد گوناگون را برای یکدیگر استفاده نکنید.
برای وزنکردن مایعات نیز میتوانید از بشر به روش قبل استفاده کنید.
 برای ساختن محلول بهتر است از ظروف شیشهای مدرج با دهانهی باریک مثل بالن کفتخت یا ارلن استفاده کنید تا هنگام همزدن محلول با مشکل سرریزشدن مواجه نشوید.
برای ساختن محلول بهتر است از ظروف شیشهای مدرج با دهانهی باریک مثل بالن کفتخت یا ارلن استفاده کنید تا هنگام همزدن محلول با مشکل سرریزشدن مواجه نشوید.
برای اندازهگیری حجم مایعات از ظروف شیشهای مدرج مانند استوانهی مدرج یا بشر استفاده کنید. هر چه درجهها ریزتر باشند، اندازهگیری شما دقیقتر خواهد بود.

مایعاتی که بخار میشوند را زیر هود اندازهگیری کنید.
روشهای محاسبهی غلظت محلول
درصد وزنی میزان گرم مادهی حلشونده در کل وزن محلول را گزارش میکند. این ویژگی بیشتر روی محصولات تجاری درج میشود. مثل الکل صنعتی 96درصد که به معنای 96 گرم الکل به ازای 4 گرم آب مقطر در هر 100 گرم از محصول است. اما در محلولسازی کاربردی در آزمایشگاهها بیشتر از روشهای زیر برای بیان غلظت محلول و محاسبهی آن استفاده میشود.
درصد وزنی/ حجمی که به اختصار درصد وزنی نیز گفته میشود اولین روش بیان کمی محلول با غلظت مشخص محلول درصد جرمی (وزنی) است. در این حالت جرم مشخصی از حلشونده در حجم معینی از حلال، حل شود. به طوری که حجم کل حلشونده و حلال (محلول) 100 سیسی گردد. (سیسی= میلیلیتر)



به مثال زیر توجه کنید:
پزشک برای درمان سرماخوردگی، شستوشوی مجاری تنفسی و بینی را با سرم فیزیولوژی یا محلول کلریدسدیم 6/0 درصد تجویز کرده است. چگونه این محلول را خودتان میسازید؟
معنای این درصد آن است که در هر 100 سیسی محلول، 6/0 گرم نمک سدیم کلرید حل شده است.

مثال:
بیایید محاسبه کنیم برای ساختن 200 سیسی محلول 5 درصد کلریدسدیم چه مقدار از مادهی حلشونده و حلال نیاز داریم.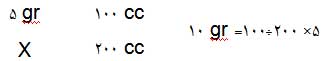
بنابراین برای ساختن چنین محلولی باید 10 گرم از نمک کلرید سدیم را در ظرف بریزیم و روی آن آب اضافه کنیم تا حجم به 200 سیسی برسد.
اگرمحلول بسیار رقیق باشد یا به عبارتی وزن موردنیاز برای آمادهکردن محلول، غلظت بر حسب قسمت در میلیون (ppm) بیان میشود. یعنی تعداد میلیگرم مادهی حلشونده در یک لیتر محلول. برای مثال غلظت آنتیبیوتیکها به این گونه گزارش میشود. زیرا مقدار موردنیاز آنها برای کارکرد کافی بسیار کم است.
محلول گرم در لیتر (غلظت=C) بیانکنندهی مقدار گرمی از مادهی حلشونده است که در یک لیتر محلول حل شده باشد و به صورت گرم در لیتر بیان میشود.

مثال :
وقتی 5 گرم گلوکز در 200 میلیلیتر از محلولی حل شده باشد، غلظت برابر 25 گرم/ لیتر خواهد بود.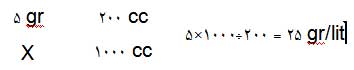
مولاریتهی یک محلول برابر است با تعداد مولهای ماده حل شده در هر لیتر آن محلول. این روش بیان غلظت بیشترین کاربرد را در محلولسازی دارد. یک مول برابر است با تعداد1023*022/6مولکول از ماده (عدد آووگادرو). برای این که تعداد مولکولهای ماده را در محلول اندازه بگیریم از مفهوم جرم مولی استفاده میکنیم.
با نگاهی به آن چه گفتیم درمییابید که با وزنکردن مادهی موردنظرتان و تقسیم آن بر جرم مولی ماده میتوانید تعداد مولهای موجود در آن مقدار ماده را به دست بیاورید و برای محلولسازی استفاده کنید.

مثال:
محلول 1 مولار کلریدسدیم شامل 1 مول کلریدسدیم در یک لیتر محلول است. که با توجه به وزن مولکولی (مولی) کلریدسدیم (=58/44 گرم) میفهمیم برای تهیهی 1000 سیسی محلول یک مولار آن باید به همین اندازه از پودر کلریدسدیم را با ترازو وزن کنیم و روی آن آب بریزیم تا حجم آن به 1000 سیسی برسد.در شکل زیر مشاهده میکنید که یک بشر کوچک روی ترازو گذاشته شده و داخل آن به اندازهی 58/44 گرم پودر ریخته شده است. سپس پودر به درون یک بالن 1 لیتری منتقل شده و به آن آب مقطر اضافه شده است تا به حجم برسد.

مثال: اگر بخواهیم 250 میلیلیتر محلولی از اسیدنیتریک بسازیم که غلظت آن 2 مولار باشد، با توجه به جرم مولکولی اسیدنیتریک (= جرم یک مول از آن) که برابر با 63/01 گرم است به روش زیر میتوانیم محاسبه کنیم. در این روش ابتدا مقدار گرمی از اسیدنیتریک که برای تهیهی 1 لیتر (=1000 سیسی) محلول 2 مولار لازم است را محاسبه میکنیم:
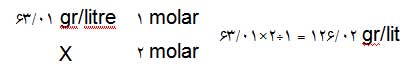
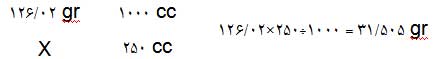
بنابراین برای آمادهکردن محلولی با مشخصات بالا باید مقدار 31/505 گرم از اسیدنیتریک را وزن کنید و در یک ظرف مدرج (ارلن یا بالن) بریزید. بعد روی آن آبمقطر اضافه کنید تا به علامت 250 سیسی برسد.
مولالیتهی یک محلول برابر است با تعداد مولهای ماده حل شده در 1 کیلوگرم حلال. این واحد در محلولسازی کاربرد چندانی ندارد.
محلول نرمال محلولی است که یک اکیوالانگرم ماده حلشونده در 1 لیتر محلول، حل شده باشد. مقدار وزن اکیوالان از رابطهی زیر به دست میآید:
E=M/n
که در آن M جرم مولکولی وn ظرفیت مادهی حلشونده میباشد. برای دریافت مفهوم اکیوالان و ظرفیت به مطلب مرتبط آن درسایت تبیان و دیگر منابع علمی مراجعه کنید.
برای ساخت محلولهای نرمال غالباً از بالنهای حجمی استفاده میشود. اگر چه مولاریته و نرمالیتهی محلولها با تغییر دما اندکی تغییر میکنند اما همچنان مولاریته کاربردیترین روش محاسبهی مقداری در محلولسازی میباشد. مولالیته یک محلول با تغییر دما ثابت میماند. زیرا محلول بر مبنای جرم اجزای سازنده آن تهیه شده است و با تغییر دما وزن تغییر نمیکند.



















