فلزات واسطه (٢)
در ادامه مطلب فلزات واسطه 1 داریم ...
در این مقاله سعی خواهیم کرد خواص فیزیکی فلزات واسطه مثل چگالی، دمای ذوب، دمای جوش و قدرت و استحکام و هم چنین خواص شیمیایی فلزات واسطه ای مانند تیتانیوم، وانادیوم، منگنز، آهن، کبالت، نیکل، مس و روی را مورد بررسی قرار دهیم.
(a) برخی ویژگی های فیزیکی عناصر واسطه:
معمولا گفته می شود که این عناصر به دلیل پیوند اتمی – اتمی قوی فلزی، سفت، بادوام و محکم هستند (در مقایسه با فلزات قلیایی گروه I).
رساناهای خوب گرما و الکتریسیته (این عناصر، الکترون های آزاد زیادی برای انتقال انرژی الکتریکی و گرمایی در هر اتم دارند). چکش خوارند و به راحتی به اشکال مختلف در می آیند. این عناصر، معمولا جامد ها یا مایعات درخشنده و صیقلی هستند.
(b) دمای ذوب و جوش بالا:
پیوند فلزی بین اتم ها در فلزات قلیایی بسیار قوی است. نیروی جاذبه قوی بین اتم ها فقط در دماهای بالا ضعیف می شود؛ به همین دلیل دمای ذوب و جوش این فلزات در مقایسه با فلزات قلیایی بیش تر است.

البته با این که جیوه یک عنصر واسطه است اما دمای ذوب آن به طور غیرعادی پایین است (-٣٩ o C )
مثال: آهن در ١٥٣٥ ° C ذوب شده و در ٢٧٥٠ ° C می جوشد؛ اما یک عنصر قلیایی مانند سدیم در ٩٨ ° C ذوب شده و در ٨٨٣ ° C می جوشد.
(c) چگالی بالا:
نتیجه دیگر پیوند قوی بین اتم های عناصر واسطه آن است که آن ها به صورت قوی در کنار هم نگه داشته شده اند و همین باعث چگالی بالای آن ها می شود.
برای مثال: دانسیته آهن 7/9 g /cm٣ است؛ در حالی که دانسیته سدیم 0/97 g /cm٣ است و در حالت یخ زده روی آب شناور می ماند (چگالی آب 1/0 g /cm٣ است).
وانادیوم |  اسکاندیوم |
منگنز |  کروم |
 روی |
نیکل |
(d) تشکیل ترکیبات رنگی و یون ها در محلول:
این فلزات واکنش پذیری کم تری نسبت به فلزات قلیایی دارند. آن ها با سرعت کمی با آب یا اکسیژن واکنش نشان می دهند؛ بنابراین دیر زنگ می زنند.
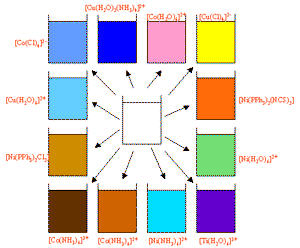
این فلزات بیش تر از عناصر دیگر علاقه دارند هم در حالت جامد و هم محلول در حلالی مانند آب، ترکیبات رنگی تشکیل دهند. مثال هایی از رنگ های نمک های برخی فلزات واسطه در محلول های آبی در زیر نشان داده شده اند؛ اغلب این ترکیبات / یون های رنگی، ساختارهای پیچیده ای دارند و به همین علت، کمپلکس (پیچیده) نامیده می شوند:
Sc – نمک های اسکاندیوم مثل کلراید اسکاندیوم ( ScCl٣ ) بی رنگ هستند و جزو فلزات واسطه نیستند.
Ti - کلراید تیتانیوم (TiCl٣) III بنفش است.
V - کلرید وانادیوم (VCl٣) سبز روشن است.
Cr - سولفات کروم (Cr٢(SO٤)) سبز تیره است (نمک های کرومات VI زرد هستند و نمک های دی کرومات VI نارنجی اند).
Mn - ترکیبات منگنز، پتاسیم منگنات (KMnO٤) VII، ارغوانی است (نمک های منگنز II مثل MnCl٢ صورتی کم رنگ هستند).
Fe - کلرید آهن (FeCl3 ) ، به رنگ های زرد، نارنجی، قهوه ای هستند:
· ترکیبات آهن II معمولا سبز روشن هستند و ترکیبات آهن III نارنجی / قهوه ای هستند.
Co - سولفات کبالت (CoSO٤) متمایل به صورتی است.
Ni - نیکل کلراید (NiCl٣) سبز روشن است.
Cu - سولفات مس (CuSO٤) آبی پر رنگ است.
· رایج ترین ترکیبات مس به شکل بلوری یا محلول ، آبی و گاهی سبز هستند.
·در محلولی به رنگ آبی شامل یون مس Cu+٢(aq) ، این یون ساختارهای پیچیده تری دارد:
** محلول در آب [Cu(H2O)6]+2 و زمانی که محلول آمونیاک اضافه می شود.
** بعد از این که رسوب ژلاتینی آبی هیدروکسید مس (Cu(OH)٢) اولیه تشکیل می شود.
Zn - نمک های روی مثل سولفات روی ZnSO٤ معمولا بی رنگ هستند و جزو فلزات واسطه نیستند.