تعادل 2:
در مطلب قبل به شرایط تعادل و انجام واکنشهای شیمیایی اشاره شد. حال ببینیم فراهم شدن شرایط واکنش، گویای کدام خاصیت فیزیکی مواد است و چه عواملی، انجام سریعتر و بهینهتر واکنشهای مواد را تحت تأثیر قرار میدهند؟
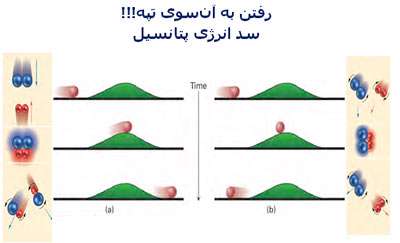
در شکل بالا به خوبی دیده میشود که برای این که واکنشی صورت پذیرد، شرایط لازم برای آن (تعداد و جهت مناسب ذرات واکنش دهنده و انرژی جنبشی کافی آن ها) چگونه تشکیل محصولات را تحت تأثیر قرار می دهد.
در حالت (a) سیستم، انرژی کافی برای رفتن به آن سوی تپه و غلبه به سد انرژی پتانسیل را دارد؛ بنابراین محصولات تشکیل میشوند.
در حالت (b) سیستم، انرژی کافی برای عبور از سد انرژی پتانسیل ندارد؛ بنابراین محصولات این برخورد ناموفق تشکیل نمیشوند.
در مطلب قبلی گفته شد که انرژی فعالسازی، حداقل انرژی لازم برای ایجاد انرژی برخورد مؤثر است تا واکنش انجام شود. با مقایسهی این مطلب و شکل قبل میبینیم که اگر شرایط انجام واکنش مهیا باشد و انرژی فعالسازی نیز کافی باشد، میتوان به سد پتانسیل غلبه کرد. به نظر شما این سد پتانسیل ناشی از چیست؟
حال ببینیم چه عواملی بر سرعت و کارایی واکنش های شیمیایی تأثیر دارند:
· دمای واکنش: با افزایش دما سرعت انجام واکنش نیز بالا می رود.
· کاتالیزگرها: کاتالیست مناسب، سرعت واکنش را بالا می برد.
· غلظت واکنش دهنده ها: غلظت زیاد واکنش دهنده ها موجب سرعت یافتن واکنش می شود.
اثر دما بر آهنگ واکنش:
در فرایند تبخیر مولکول های آب در یک ظرف در بستهی نیمه پر، مولکول ها در فضای گازی بالای آب در حال تبخیر، توزیعی از سرعت های مختلف دارند؛ برخی از این مولکول ها کند و برخی بسیار سریع حرکت می کنند.
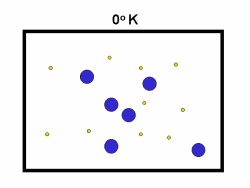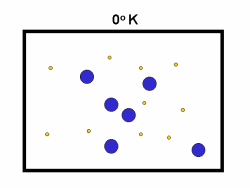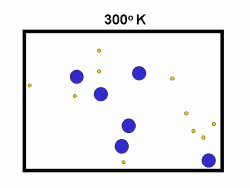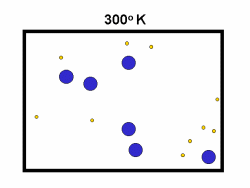
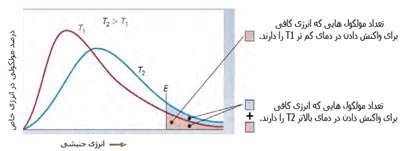
شکل بالا این مطلب را به خوبی نشان میدهد؛ دایرههای آبی، مولکولهاییاند که سرعت حرکت بالایی دارند و دایرههای قرمز، مولکول هاییاند که سرعت کمی دارند. حال ببینیم تغییر دما چه تأثیری بر روی سرعت مولکول ها دارد؟
· تنها کسری از مولکولهای نشان داده شده در ناحیهی پایینی منحنی در سمت راست، انرژی جنبشی کافی برای واکنش دادن دارند.
· کسر بزرگی از مولکولها میتوانند در دماهای بالاتر واکنش دهند.
در زندگی روزمره نیز واکنشهای شیمیایی فراوانی را در همین ارتباط مشاهده میکنیم؛ به عنوان مثال، آهنگ فاسد شدن غذای منجمد شده نسبت به غذایی که در دمای عادی نگهداری میشود، کمتر است. همچنین، غذا در زودپز خیلی سریعتر از حالت عادی پختن غذا میپزد زیرا در دمای بالاتری به جوش میآید اما همین غذا اگر در منطقهای که ارتفاع بالایی نسبت به سطح دریا دارد پخته شود، دیر خواهد پخت؛ زیرا فشار پایینتر، نقطهی جوش را پایینتر میآورد.
نقش کاتالیزورها در آهنگ واکنش:
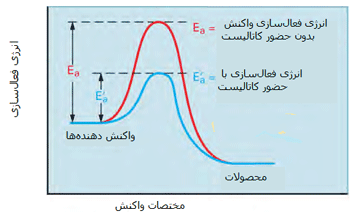
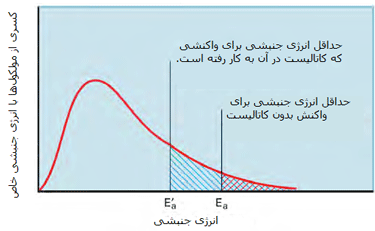
مطابق شکل زیر، یک کاتالیست راهی را فراهم میکند که واکنش با انرژی فعالسازی کمتری اتفاق بیفتد؛ بنابراین بیشتر مولکولهایی که انرژی جنبشی کمتری دارند، قادر خواهند بود از سد انرژی پتانسیل عبور کنند.
در شکل دوم، کسری از مولکولها با انرژی کافی برای وارد شدن به برخوردهایی که باعث انجام واکنش میشوند، در صورت وجود کاتالیست افزایش پیدا میکند زیرا سد انرژی فعالسازی پایین میآید.
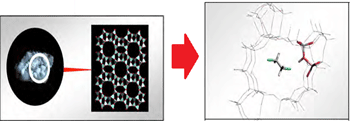
حال مثالی از نقش کاتالیست زئولیت (نوعی سیلیکات آبدار) در انجام واکنش میآوریم تا این مطلب را به خوبی درک کنید:
زئولیتها جامدهایی با شبکهی کوالانسیاند و دارای حفرهها و کانالهایی خاص هستند و مولکولهای گازی میتوانند از طریق این کانالها پخش شوند. زمانی که دو مولکول گاز درون زئولیت با همدیگر روبهرو میشوند، مجبور به نزدیک شدن به هم در یک جهت ویژه میشوند (این جهت ویژه، جهتگیری درست برای انجام واکنش است). این دو مولکول مدت طولانی را با هم میمانند و شانس بیشتری برای واکنش دارند. طبیعت کاتالیستها این است که به طور مستقیم در واکنش شرکت میکنند (اما واکنشدهنده یا محصول نیستند) و محیط مناسبی برای انجام واکنش فراهم کرده و سد انرژی فعالسازی را پایین میآورند.
تأثیر غلظت بر سرعت واکنش:
آهنگ یک واکنش به تعداد برخوردها در واحد زمان نیز بستگی دارد. هرچه تعداد ذرات موجود در حجم خاص که واکنش در آن صورت میگیرد زیاد باشد، برخوردهای متوالی بیشتری اتفاق خواهد افتاد و واکنشها با سرعت بیشتری انجام خواهند گرفت. به شکل زیر که سوختن برادهی فولاد در اکسیژن را نشان میدهد، توجه کنید:

در ردیف اول، برادهی فولاد در هوا (غلظت کم اکسیژن) حرارت داده میشود. در ردیف دوم، برادهی فولاد در اکسیژن خاص حرارت داده میشود. این مشاهده براساس توجیهات بالا کاملاً قابل درک است.