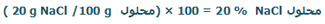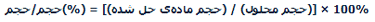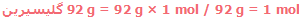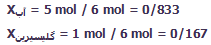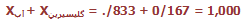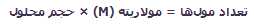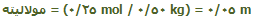غلظت
غلظت یک محلول شیمیایی به مقدار مادهی حل شدهای که در مادهی حل شونده، حل شده است، ربط دارد. تصور ما بر این است که جامدی به یک حل کننده اضافه میشود (مثلاً نمک به آب) اما مادهی حلشده در فاز دیگری است. برای مثال، اگر مقدار کمی اتانول به آب اضافه کنیم، اتانول، مادهی حلشده است و آب حلال. اگر مقدار کمتری آب به مقدار بیشتری اتانول اضافه کنیم، آب نقش مادهی حلشده را خواهد داشت!
واحدهای غلظت
زمانی که مادهی حل شده و حلال را در یک محلول شناسایی کنید، برای تعیین غلظت آمادگی دارید. ممکن است غلظت با استفاده از چند روش مختلف ترکیب درصدی توسط جرم، درصد حجمی، کسر مولی، مولاریته، مولالیته یا نرمالیته شرح داده شود.
1. ترکیب درصدی توسط جرم (%): جرم مادهی حلشده تقسیم بر جرم محلول (جرم مادهی حلشده به اضافهی جرم حلال) ضرب در 100، درصد نسبت اجزای سازندهی جرمی نامیده میشود.
مثال:
درصد نسبت اجزای سازندهی جرمی 100 g محلول نمک که شامل20 g نمک است را تعیین کنید.
پاسخ:
2. درصد حجمی (% v/v):
درصد حجمی یا درصد حجم / حجم اغلب هنگام آماده کردن محلول مایعات استفاده میشود. درصد حجمی به صورت زیر تعریف میشود:
توجه کنید که درصد حجمی به حجم محلول وابسته است نه به حجم حلال. برای مثال، 70 % الکل ممکن است با برداشتن 700 ml الکل ایزوپروپیل و افزودن آب کافی به آن همراه باشد تا1000 ml محلول به دست آید (که300 ml نخواهد یود).
3. کسر مولی (X):
تعداد مولهای یک ترکیب، تقسیم بر تعداد کل مولهای تمام اجزای شیمیایی محلول، کسر مولی نام دارد. به خاطر داشته باشید که جمع کسرهای مولی تمام مواد موجود در محلول همیشه مساوی 1 است.
مثال:
کسر مولی اجزای سازندهی محلول متشکل از 92 g گلیسیرین و 90 g آب چهقدر است؟ ( وزن مولکولی آب = 18؛ وزن مولکولی گلیسیرین = 92)
پاسخ:
کل مولها= 6=5+1
اکنون برای امتحان درستی جواب خود بهتر است کسر مولی اجزا را با هم جمع کنید تا مطمئن شوید جواب مساوی 1 است:
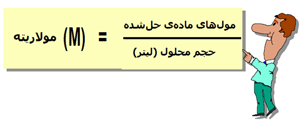
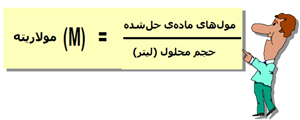
4. مولاریته (M):
مولاریته معمولیترین واحد مورد استفاده برای تعیین غلظت است. تعداد مولهای مادهی حلشده در هر لیتر محلول (که الزاماً با حجم حلال یکی نیست) مولاریته نام دارد.
مثال:
برای اینکه یک محلول 1 مولار از HCl داشته باشیم، چه کاری باید انجام دهیم؟
پاسخ:
جرم مولی HCl = (1/0+35/5) gmol-1 = 36/5 gmol-1
بنابراین 1 مول از اسید هیدروکلریک، 36.5 گرم وزن دارد. زمانی که 36.5 g از HCl در آب حل میشود تا 1 dm3 محلول بسازد، گفته میشود که محلول دارای غلظت 1 مول در هر dm3 یا 1 مولار است و یا اینکه گفته میشود محلول 1M است.
اگر 73.0 g از HCl در آب حل شود تا محلولی با حجم 1 dm3 بسازد، محلول2 M به دست میآید.
از روی فرمول بالا میتوان نوشت:
5. مولالیته (m) :
مولاریته، تعداد مولهای مادهی حلشده در هر کیلوگرم حلال است. به دلیل اینکه چگالی آب در 25° C حدود 1 کیلوگرم در هر لیتر است، مولالیته در این دما برای محلولهای آبی رقیق تقریباً مساوی با مولاریته است. این یک تقریب مفید است اما به خاطر داشته باشید که این تنها یک تقریب است و زمانی که محلول در یک دمای دیگر است، رقیق نیست یا از حلال دیگری جز آب استفاده شود، از این تقریب نمیتوان استفاده کرد.
مثال:
مولالیتهی محلول 10 g از NaOH در 500 g آب چهقدر است؟
پاسخ:
10 g NaOH / (40 g NaOH / 1 mol NaOH)= 0.25 mol NaOH
6. نرمالیته (N) :
نرمالیته با وزن اکی والان گرم (وزن همارز گرم) مادهی حلشده در هر لیتر محلول است. وزن همارز گرم یا اکی والان، یک اندازهگیری از ظرفیت واکنشی مولکول موجود است. نرمالیته تنها واحد غلظت است که به واکنش وابسته است.
مثال:
1 M اسید سولفوریک (H2SO4) برای واکنش اسید و باز، دارای نرمالیتهی 2 است زیرا هر مول اسید سولفوریک، 2 مول از یونهای H+ فراهم میکند. از طرف دیگر، 1 M اسید سولفوریک برای رسوب سولفات، دارای نرمالیتهی 1 است، چون 1 مول اسید سولفوریک، 1 مول یون سولفات فراهم میکند.
مرکز یادگیری سایت تبیان
تهیه و تنظیم: خدیجه آلچالانلو