
خواص اتمی و فیزیکی هالوژن ها (1)
در این مطلب با گرایش های فیزیکی و اتمی مانند شعاع اتمی، الکترونگاتیوی، الکترون خواهی و دمای ذوب و جوش در فلوئور، کلر، برم و ید آشنا می شویم.
همچنین در ادامه با آنتالپی پیوند (قدرت) پیوندهای هالوژن – هالوژن و پیوندهای هیدروژن – هالوژن آشنا خواهیم شد.
 |  |
 |  |
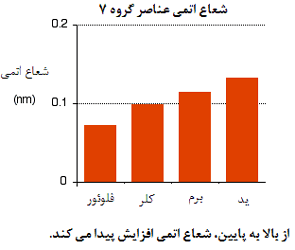
تغییرات شعاع اتمی:
توضیح علت افزایش شعاع اتمی:
شعاع یک اتم توسط عامل های زیر کنترل می شود:
- تعداد لایه های الکترون های اطراف هسته
- کششی که الکترون های بیرونی تر از هسته احساس می کنند.
با مقایسه فلوئور و کلر، تعداد الکترون های هر لایه خواهد بود:

در هر مورد، الکترون های خارجی، کشش خالص +7 را از سوی هسته احساس می کنند. بار مثبت بر روی هسته توسط منفی بودن الکترون های داخلی کم می شود.
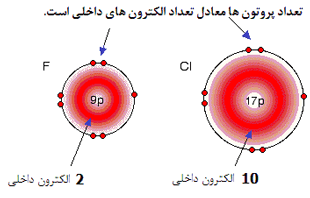
این روند برای تمام اتم های گروه 7 نیز صادق است.
بنابراین تنها عاملی که اندازه اتم را تحت تأثیر قرار می دهد، تعداد لایه های الکترون های داخلی است که باید در اطراف اتم جا بگیرند. بدیهی است که لایه های بیش تر الکترونی، جای بیش تری اشغال خواهد کرد (چون الکترون ها در این حالت، بیش تر همدیگر را دفع خواهند کرد). این به معنای آن است که با پایین رفتن در این گروه، اتم ها بزرگ تر شوند.
تغییرات الکترونگاتیوی:
الکترونگاتیوی، اندازه گیری تمایل یک اتم برای جذب جفت الکترون های پیوندی است. معمولا از مقیاس پالینگ برای اندازه گیری الکترونگاتیوی استفاده می شود که فلوئور، الکترونگاتیوترین عنصر جدول تناوبی است.
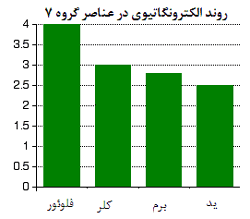
توجه کنید که با پایین رفتن در این گروه، الکترونگاتیوی کاهش پیدا می کند.
توضیح علت کاهش الکترونگاتیوی:
این علت به سادگی از شکل های فلوئورید هیدروژن و کلرید هیدروژن فهمیده می شود:
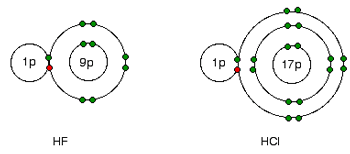
جفت های پیوندی الکترون ها بین هیدروژن و هالوژن، همان کشش خالص +7 را از هر دو اتم کلر و فلوئور احساس می کند. اما در مورد کلر، هسته دورتر از جفت پیوندی است. این به معنای آن است که کلر به شدت فلوئور، جذب نمی شود.

کشش بزرگ تر از هسته نزدیک تر فلوئور، دلیل الکترونگاتیوتر بودن فلوئور نسبت به کلر است.
همچنان که هالوژن ها بزرگ تر می شوند، هر جفت پیوندی از هسته هالوژن دورتر می شود؛ بنابراین با قدرت کم تری جذب هسته اتم می شود. به بیان دیگر از بالا به پایین، الکترونگاتیوی کم می شود.

تغییرات اولین الکترون خواهی:
اولین انرژی الکترون خواهی، انرژی آزاد شده ای است که 1 مول از اتم های گازی، یک الکترون به دست می آورد تا 1 مول از یون -1 تشکیل دهد:
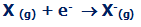
وقتی این تغییر اتفاق می افتد، انرژی اولین الکترون خواهی، انرژی آزاد شده در هر مول اتم X است.
این انرژی، مقدار منفی دارد. برای مثال، اولین الکترون خواهی کلر، -394 KJ/mol است. طبق قرارداد، علامت منفی نشان دهنده آزاد شدن انرژی است.
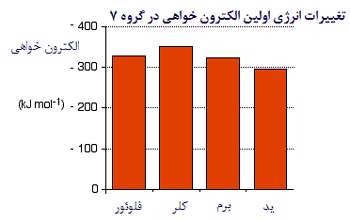
توجه کنید که روند تغییرات الکترون خواهی در گروه، منظم نیست. به استثنای فلوئور، مقادیر الکترون خواهی کم تر می شود (گرمای کم تری آزاد می شود).
الکترون خواهی، اندازه گیری جاذبه بین الکترون ورودی به یک اتم و هسته است.جاذبه بیش تر به معنای الکترون خواهی بیش تر است.
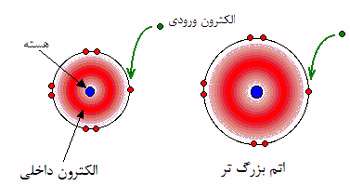
در اتم بزرگ تر، جاذبه از هسته ای با بار مثبت بیش تر، توسط الکترون های محافظ خنثی می شود؛ بنابراین هر الکترون ورودی، اثر بار خالص +7 را از مرکز اتم احساس می کند؛ دقیقا مثل حالت شعاع اتمی یا الکترونگاتیوی.
وقتی اتم، بزرگ تر می شود، الکترون ورودی از هسته دورتر می شود و جاذبه کم تری احساس می کند. پس مقدار الکترون خواهی در این گروه از بالا به پایین کاهش می یابد.
اما چرا فلوئور فرق دارد؟
فلوئور، اتم بسیار کوچکی است، پس الکترون ورودی به هسته فلوئور بسیار نزدیک است. پس چرا الکترون خواهی آن از کلر کم تر است؟
در این مورد، عامل دیگری نقش دارد. وقتی الکترون تازه ای به یک اتم اضافه می شود، وارد فضایی با بار منفی زیاد به دلیل الکترون های موجود می شود. بنابراین دافعه ناشی از این الکترون ها مقداری از جاذبه هسته را خنثی می کند.
چون اتم فلوئور بسیار کوچک است، چگالی الکترونی بسیار بالاست. این به معنای آن است که دافعه زیاد است و چاذبه هسته را آن قدر کم می کند که الکترون خواهی فلوئور کم تر از کلر باشد.

















