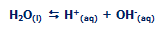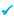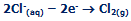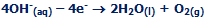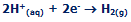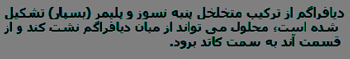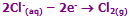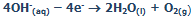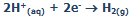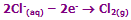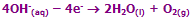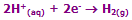تهیه کلر از سلول دیافراگمی و غشایی
در این آزمایش، به وسیله دو سلول مختلف، از الکترولیز محلول سدیم کلراید، کلر به دست خواهیم آورد.
شیمی فرایند الکترولیز:
- یون های سدیم
- یون های کلراید
- یون های هیدروژن (از آب)
- یون های هیدروکسید (از آب)
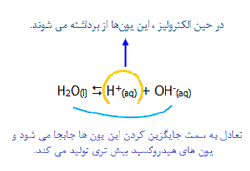
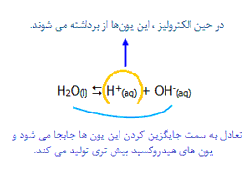
یون های هیدروکسید و هیدروژن از تعادل زیر حاصل می شوند:
در هر زمان، غلظت یون های هیدروژن یا یون های هیدروکسید بسیار کم خواهد بود؛ موقعیت تعادل به سمت چپ معادله قرار می گیرد.
معادلات در آند:
یون های منفی کلراید و هیدروکسید به سمت قطب با بار مثبت (آند) جذب می شوند. آزاد کردن یون های هیدروکسید (برای دادن به اکسیژن) راحت تر از یون ها ی کلراید (برای دادن به کلر) است؛ اما یون های کلراید زیادتر از یون های هیدروکسید به آند می رسند.
پس معادله اصلی در آند خواهد بود:
با این وجود، کلر با مقادیر کم اکسیژن در واکنش یون های هیدروکسیدی که الکترون خود را می دهند، آمیخته می شود و خالص نیست:
معادلات در کاتد:
یون های سدیم و یون های هیدروژن (از آب) به کاتد منفی متصل می شوند. یون هیدروژن، راحت تر از یون سدیم می تواند یک الکترون به دست آورد؛ پس:
محصولات بایستی جدا بمانند!
اگر کلر در تماس با هیدروژن باشد، ترکیبی تولید می کند که اگر در معرض نور خورشید یا حرارت قرار گیرد، به شدت منفجر خواهد شد. این محصول، گاز کلرید هیدروژن است؛ پس بایستی این دو گاز از هم جدا قرار گیرند.
|
سوختن کلر در گاز هیدروژن |
با این وجود، کلر با محلول هیدروکسید سدیم واکنش می دهد تا ترکیب سدیم کلراید و سدیم کلرات (I) – یا سدیم هیپوکلریت - تولید شود. این ترکیب به عنوان سفیدکننده به فروش می رسد.
سلول دیافراگمی (دریچه ای) و غشایی طوری طراحی شده اند که محصولات این الکترولیز جدا از هم بمانند.
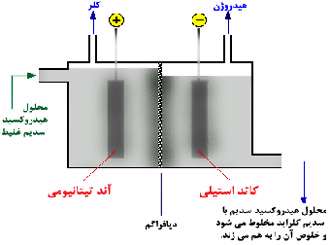
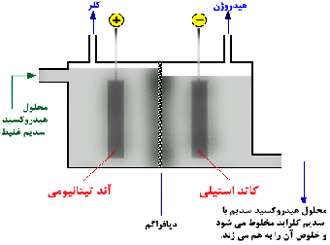
سلول دیافراگمی:
تولید کلر:
طبق معادله زیر، کلر در آند تیتانیومی تولید می شود:
اما به دلیل معادله زیر با کمی اکسیژن هم مخلوط می شود و خالص نیست:
اگر گاز کلر را تحت فشار به مایع تبدیل کنیم، خالص می شود. وقتی اکسیژن در دماهای معمولی فشرده می شود، به صورت گاز باقی می ماند.
تولید هیدروژن:
هیدروژن در کاتد استیل تولید می شود:
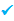
تولید هیدروکسید سدیم:
محلول رقیق هیدروکسید سدیم در کاتد هم تولید می شود و با محلول سدیم کلراید تغییر نیافته مخلوط می شود.
محلول هیدروکسید سدیمی که از سلول بیرون می رود، با تبخیر غلیظ می شود. طی این فرایند، بیش تر سدیم کلراید به صورت نمک جامد بلورینه می شود. این نمک می تواند جدا شده و در آب حل شود و دوباره از سلول عبور کند.
حتی بعد از غلیظ شدن، هیدروکسید سدیم، درصد کوچکی از سدیم کلراید خواهد داشت.
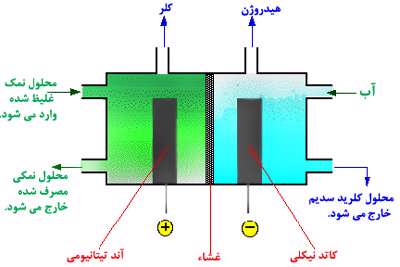
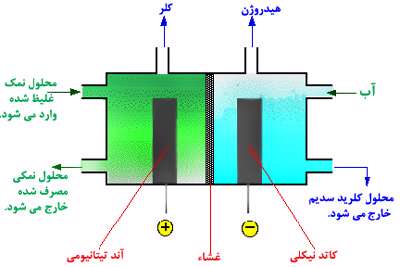
سلول غشایی:
مزیت این روش آن است که محلول هیدروکسید سدیم که در قسمت سمت راست تولید می شود، با هیچ محلول سدیم کلراید دیگری آمیخته نمی شود.
محلول سدیم کلراید مورد استفاده باید خالص باشد، اگر این محلول شامل هر گونه یون فلزی دیگری باشد، این یون هم از غشاء رد خواهد شد؛ بنابراین با محلول سدیم کلراید مخلوط خواهد شد.
تولید کلر:
طبق معادله زیر، کلر در آند تیتانیومی تولید می شود:
این گاز طبق معادله زیر با مقداری اکسیژن آمیخته می شود:
با مایع کردن کلر تحت فشار، خالص شود. اما اکسیژن باز هم با فشرده شدن در دماهای معمولی، حالت گازی خود را حفظ می کند.
تولید هیدروژن:
هیدروژن در کاتد نیکلی تولید می شود:
تولید هیدروکسید سدیم:
تقریبا 30% محلول هیدروکسید سدیم در کاتد هم تولید می شود.
مرکز یادگیری سایت تبیان - تهیه و تنظیم: خدیجه آلچالانلو